
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)第一组同学称取样品m
①为完成测定,以下图示中还缺少的仪器名称是_______________________。
②为了减少实验误差,在加热至恒重的过程中应如何操作。
___________________________________________________________________。
③若坩埚质量为m
(2)第二组同学称取样品m g,设计了如下图所示的装置:
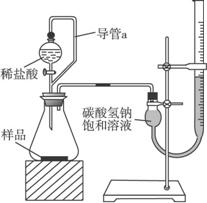
①装置中导管a的作用是________________________________________________________。
②实验结束时,该组同学在测量实验中生成气体体积时应注意哪些问题?
____________________________________________________________________
____________________________________________________________________。
(3)分析上述两组实验方案,你认为哪组实验方案的误差会小些。
____________________________________________________________________。
(4)请你设计一种除上述实验原理以外的方案,写出反应的化学方程式。
____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省绍兴市鲁迅中学高二下学期期末考试化学试卷(带解析) 题型:实验题
(14分)实验和探究对化学学科的发展起着非常重要的作用
(1)写出下列实验过程中所体现的总的离子反应方程式:
①用PH试纸测得醋酸钠溶液呈碱性:__________
②用石墨做电极,电解硝酸银溶液后,溶液呈酸性:__________
③根据浑浊出现的快慢,探究硫代硫酸钠与酸反应速率的影响因素:__________
(2)已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放入6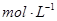 NaOH溶液中,判断锌层完全反应的标志是:__________,最后,取出铁片用水冲洗、烘干后称量,得质量为m2,设锌镀层单侧厚度为h,锌的密度为
NaOH溶液中,判断锌层完全反应的标志是:__________,最后,取出铁片用水冲洗、烘干后称量,得质量为m2,设锌镀层单侧厚度为h,锌的密度为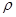 ,则h=__________
,则h=__________
(3)实验室测定绿矾中FeSO4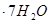 含量的步骤是:称1g绿矾,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol/L KMnO4标准溶液滴定到溶液刚变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有:
含量的步骤是:称1g绿矾,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol/L KMnO4标准溶液滴定到溶液刚变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有: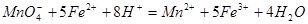
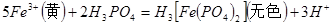
①绿矾的含量为__________%。
②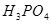 的作用是__________。
的作用是__________。
查看答案和解析>>
科目:高中化学 来源:2013届浙江省绍兴市高二下学期期末考试化学试卷(解析版) 题型:实验题
(14分)实验和探究对化学学科的发展起着非常重要的作用
(1)写出下列实验过程中所体现的总的离子反应方程式:
①用PH试纸测得醋酸钠溶液呈碱性:__________
②用石墨做电极,电解硝酸银溶液后,溶液呈酸性:__________
③根据浑浊出现的快慢,探究硫代硫酸钠与酸反应速率的影响因素:__________
(2)已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放入6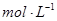 NaOH溶液中,判断锌层完全反应的标志是:__________,最后,取出铁片用水冲洗、烘干后称量,得质量为m2,设锌镀层单侧厚度为h,锌的密度为
NaOH溶液中,判断锌层完全反应的标志是:__________,最后,取出铁片用水冲洗、烘干后称量,得质量为m2,设锌镀层单侧厚度为h,锌的密度为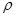 ,则h=__________
,则h=__________
(3)实验室测定绿矾中FeSO4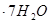 含量的步骤是:称1g绿矾,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol/L KMnO4标准溶液滴定到溶液刚变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有:
含量的步骤是:称1g绿矾,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol/L KMnO4标准溶液滴定到溶液刚变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有:
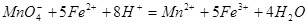
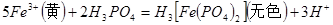
①绿矾的含量为__________%。
②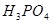 的作用是__________。
的作用是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com