
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:___________________________
________________________________________________________________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_________________________________________________________________
________________________________________________________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO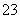 )∶n(HSO
)∶n(HSO )变化关系如下表:
)变化关系如下表:
| n(SO | 91∶9 | 1∶1 | 9∶91 |
| pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显________性,用化学平衡原理解释:_____________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):________。
a.c(Na+)=2c(SO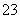 )+c(HSO
)+c(HSO )
)
b.c(Na+)>c(HSO )>c(SO
)>c(SO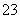 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO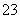 )+c(HSO
)+c(HSO )+c(OH-)
)+c(OH-)
(4)(201 2·福建高考节选)能证明Na2SO3溶液中存在SO
2·福建高考节选)能证明Na2SO3溶液中存在SO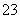 +H2OHSO
+H2OHSO +OH-水解平衡的事实是________(填序号)。
+OH-水解平衡的事实是________(填序号)。
A.滴入酚酞溶液变红 ,再加入H2SO4溶液后红色褪去
,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
解析:(1)二氧化硫形成硫酸型酸雨的过程为二氧化硫与水反应生成亚硫酸,亚硫酸再被氧化成硫酸。
(2)氢氧化钠溶液吸收二氧化硫生成亚硫酸钠和水,而亚硫酸钠溶液可以继续吸收二氧化硫生成亚硫酸氢钠。
(3)①由表格数据知,随n(HSO )的增大,溶液酸性增强,即HSO
)的增大,溶液酸性增强,即HSO 的电离程度大于水解程度,亚硫酸氢钠溶液呈酸性。②由表格数据知,当溶液中亚硫酸氢钠的浓度略大于亚硫酸钠的浓度时,溶液呈中性,故离子浓度关系有c(Na+)>c(HSO
的电离程度大于水解程度,亚硫酸氢钠溶液呈酸性。②由表格数据知,当溶液中亚硫酸氢钠的浓度略大于亚硫酸钠的浓度时,溶液呈中性,故离子浓度关系有c(Na+)>c(HSO )>c(SO
)>c(SO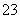 )>c(H+)=c(OH-),b正确。由电荷守恒式c(Na+)+c(H+)=2c(SO
)>c(H+)=c(OH-),b正确。由电荷守恒式c(Na+)+c(H+)=2c(SO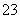 )+c(HSO
)+c(HSO )+c(OH-),中性溶液中c(H+)=c(OH-)知,a正确,c错误。
)+c(OH-),中性溶液中c(H+)=c(OH-)知,a正确,c错误。
(4)H2SO4溶液显酸性、氯水具有漂白作用,A、B均不能证明平衡移动了;加入BaCl2溶液后,平衡发生移动。
答案:(1)SO2+H2OH2SO3、2H2SO3+O2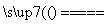 2H2SO4
2H2SO4
(2)2OH-+SO2===H2O+SO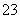
(3)①酸 HSO 存在:HSO
存在:HSO H++SO
H++SO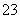 和HSO
和HSO +H2OH2SO3+OH-,HSO
+H2OH2SO3+OH-,HSO 的电离程度大于水解程度
的电离程度大于水解程度
②ab
(4)C


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
下列离子方程式书写正确的是
A.Cu与FeCl3溶液反应:Cu+ Fe3+= Cu2++ Fe2+
B.碳酸钙溶于稀盐酸:CO32- + 2H+ = H2O + CO2↑
C.金属钠与水反应:2Na+2 H2O=2Na ++2OH- + H2↑
D.氯气溶于水:Cl2 + H2O = 2H+ + ClO- + Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
某恒温密闭容器中,可逆反应A(s)B+C(g) ΔH=Q kJ/mol (Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是( )
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗∶n(C)消耗=1∶1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1 mol B和1 mol C,达到平衡时放出热量Q
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
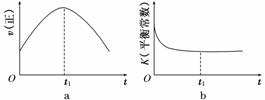
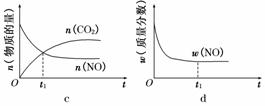
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g)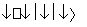 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
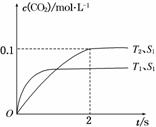
据此判断:
①该反应的ΔH________0(填“>”或“<”)
②在T2温度下,0~2 s内的平均反应速率v(N2)=______________________。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产 生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH1=-867 kJ/mol
2NO2(g)N2O4(g) ΔH2=-56 .9 kJ/mol
.9 kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式:________________________________________________________________________。
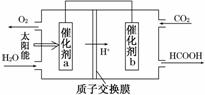
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的
目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为__________________________。
③常温下,0.1 mol·L-1的HCOONa溶液pH为10,则HCOOH的电离常数Ka=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时,M(OH)2(s)M2+(aq)+2OH-(aq) Ksp=a。c(M2+)=b mol·L-1时,溶液的pH等于( )
A.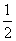 lg(
lg(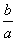 ) B.
) B.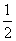 lg(
lg(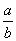 )
)
C.14+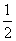 lg(
lg(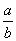 ) D.14+
) D.14+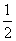 lg(
lg(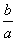 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,在等体积的①pH=0的H2SO4溶液、②0.05 mol/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
A.1∶10∶1010∶109 B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109 D.1∶10∶104∶109
查看答案和解析>>
科目:高中化学 来源: 题型:
为了证明一水合氨(NH3·H2O)是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:0.010 mol·L-1氨水、0.1 mol·L-1NH4Cl溶液、NH4Cl晶体、酚酞试剂、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确?________(填“是”或“否”)并说明理由_______________________
________________________________________________________________________。
(2)乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测出其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测出其pH为b,若要确认NH3·H2O是弱电解质,则a、b值应满足什么关系?________(用“等式”或“不等式”表示)。
(3)丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞溶液,显粉红色,再加入NH4Cl晶体少量,颜色变浅。你认为这一方法能否证明NH3·H2O是弱电解质?并说明原因:
________________________________________________________________________
________________________________________________________________________。
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明 NH3·H2O是弱电解质:
NH3·H2O是弱电解质:
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组在查阅资料时发现:
实验室制备苯甲醇和苯甲酸的化学原理是:
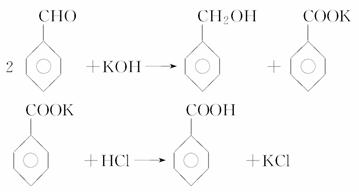
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3 ℃,苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
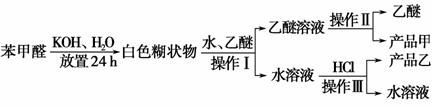
试根据上述信息回答下列问题:
(1)操作Ⅰ的名称是________,乙醚溶液中所溶解的主要成分是________。
(2)操作Ⅱ的名称是________,产品甲是________。
(3)操作Ⅲ的名称是________,产品乙是________。
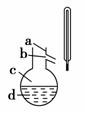 (4)如右图所示,操作Ⅱ中温度计水银球上沿放置的位置应是________(填“a”、“b”、“c”或“d”),该操作中,除需蒸馏烧瓶、温度计外,还需要的玻璃仪器是________________,收集产品甲的适宜温度为________。
(4)如右图所示,操作Ⅱ中温度计水银球上沿放置的位置应是________(填“a”、“b”、“c”或“d”),该操作中,除需蒸馏烧瓶、温度计外,还需要的玻璃仪器是________________,收集产品甲的适宜温度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,浓度均为0.1 mol/L 的下列四种盐溶液,其pH测定如下表所示:
| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
下列说法正确的是( )
A.四种溶液中,水的电离程度①>②>④>③
B.Na2CO3和NaHCO3溶液中,粒子种类相同
C.将等浓度的CH3COOH和HClO溶液比较,pH小的是HClO
D.Na2CO3溶液中, c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com