
【题目】(1)SiH4是一种无色的气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O,已知室温下2g SiH4自燃放出热量89.2kJ,其热化学方程式为:_______
(2)已知60g C(s)与高温水蒸气反应制取CO和H2时吸收657.5kJ热量,写出热化学方程式_____________。
(3)某次发射火箭,用气态N2H4(肼)在NO2气体中燃烧,生成N2、液态H2O。已知:
① N2(g)+2O2(g)=2NO2(g) ΔH1=+67.2kJ/mol
② N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH2=-534kJ/mol,
假如都在相同状态下,请写出发射火箭反应的热化学方程式。_______。
(4)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如下图所示的原电池,回答下列问题:

①写出正极电极反应式:___________;
②图中X溶液是_______,铜电极发生___________反应(填“氧化”或“还原”)。
③盐桥中的_____(填“阳”、“阴”)离子向X溶液方向移动。
【答案】SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) ΔH=-1427.2kJ·mol-1 C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.5kJ·mol-1 2N2H4(g)+ 2NO2(g)= 3N2(g)+4H2O(l) ΔH=-1135.2kJ·mol-1 Fe3++e-=Fe2+ FeCl3 氧化 阳
【解析】
(1)首先根据甲硅烷的质量计算1mol甲硅烷燃烧放出的热量,再书写热化学方程式;
(2)首先计算60gC的物质的量,再计算1mol碳与水蒸气反应吸收的热量,最后书写热化学方程式;
(3)根据盖斯定律计算所需要的热化学方程式;
(4)Cu+2FeCl3=CuCl2+2FeCl2中Cu元素化合价由0价变为+2价、Fe元素化合价由+3价变为+2价,所以Cu作负极,C为正极,FeCl3溶液为电解质溶液,据此分析解答。
(1)n(SiH4)=![]() =
=![]() mol,则1molSiH4燃烧放出的热量为:44.6kJ×32=1427.2kJ,热化学方程式为:SiH4(g)+O2(g)=SiO2(g)+H2O(l) △H=-1427.2kJ/mol,故答案为:SiH4(g)+O2(g)=SiO2(g)+H2O(l) △H=-1427.2kJ/mol;
mol,则1molSiH4燃烧放出的热量为:44.6kJ×32=1427.2kJ,热化学方程式为:SiH4(g)+O2(g)=SiO2(g)+H2O(l) △H=-1427.2kJ/mol,故答案为:SiH4(g)+O2(g)=SiO2(g)+H2O(l) △H=-1427.2kJ/mol;
(2)60g C(s)的物质的量为![]() =5mol,5mol碳与适量水蒸气反应生成CO和H2,需吸收657.5kJ热量,则1mol碳与水蒸气反应吸收热量
=5mol,5mol碳与适量水蒸气反应生成CO和H2,需吸收657.5kJ热量,则1mol碳与水蒸气反应吸收热量![]() =131.5kJ,则此反应的热化学方程式为C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJmol-1,故答案为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJmol-1;
=131.5kJ,则此反应的热化学方程式为C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJmol-1,故答案为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJmol-1;
(3)①N2(g)+2O2(g)═2NO2(g)△H1=+67.2kJ/mol,②N2H4(g)+O2(g)═N2(g)+2H2O(l)△H2=-534kJ/mol,由盖斯定律②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.2kJ/mol,故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.2kJ/mol;
(4)①C为正极,发生还原反应,电极方程式为2Fe3++2e-=2Fe2+,故答案为:2Fe3++2e-=2Fe2+;
②Cu+2FeCl3=CuCl2+2FeCl2中铜被氧化,发生氧化反应,为原电池负极,由装置图可知,Y是氯化铜溶液,则X溶液是FeCl3,故答案为:FeCl3;氧化;
③铜为负极,C为正极,则X是正极池,Y为负极池,原电池工作时,盐桥中的阳离子向X溶液方向移动,故答案为:阳。


科目:高中化学 来源: 题型:
【题目】(1)设阿伏加德罗常数为NA,标准状况下,某O2和N2的混合气体m g含有b个分子,则ng该混合气体在相同状况下所占的体积是___L。
(2)在xR2++yH++O2═mR3++nH2O的离子方程式中,对化学计量数m和R2+、R3+判断正确的是___。
A.m=y,R3+是氧化产物 B.m=2y,R2+被氧化
C.m=2,R3+是氧化剂 D.m=4,R2+是还原剂
(3)用双线桥法标出下列反应的电子转移方向和数目。___
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年2月17日下午,在国务院联防联控机制发布会上,科技部生物中心副主任孙燕荣告诉记者:磷酸氯喹对“COVID-19”的治疗有明确的疗效,该药是上市多年的老药,用于广泛人群治疗的安全性是可控的。其合成路线如图所示:
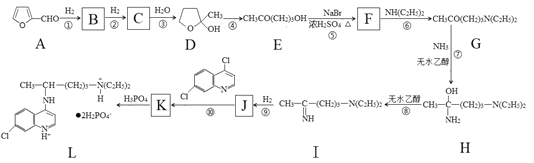
已知:醛基在一定条件下可以还原成甲基。回答下列问题:
(1)有机物A为糠醛,它广泛存在于各种农副产品中。A中含氧官能团的名称为______,A与新制氢氧化铜悬浊液反应的化学方程式为_______。
(2)C的结构简式为________,D与E之间的关系为_______。
(3)反应⑦的反应类型为_______;反应⑤若温度过高会发生副反应,其有机副产物的结构简式为____。
(4)有机物E有多种同分异构体,其中属于羧酸和酯的有______种,在这些同分异构体中,有一种是羧酸,且含有手性碳原子,其名称为_________。
(5)以2—丙醇和必要的试剂合成2—丙胺[CH3CH(NH2)CH3]:_________(用箭头表示转化关系,箭头上注明试剂)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.Ba(OH)2和H2SO4两溶液混合:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.氯气溶于水:H2O+Cl2= 2H++ Cl-+ClO-
C.锌和硝酸银溶液反应:Zn+Ag+=Ag+Zn2+
D.向Al2(SO4)3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“人工肾脏”是利用间接电化学方法除去人体代谢产物中的尿素![]() ,有关反应为:
,有关反应为:![]() ,电解原理如图所示.下列有关说法不正确的是
,电解原理如图所示.下列有关说法不正确的是
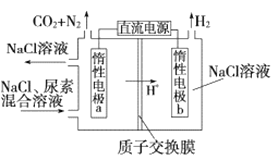
A.电极a与电源的正极相连
B.电极b附近溶液pH升高
C.电极a上的电极反应为2Cl--2e-=Cl2↑
D.每除去1 mol尿素,就有6 mol![]() 通过质子交换膜
通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.158 | 158 |
硝酸银 | 0.04 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是__________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸
(2)在溶液配制过程中,下列操作正确且对配制结果没有影响的是__________。
A.将药品放入容量瓶中加蒸馏水溶解
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(3)配制上述500mL“鲜花保鲜剂”所需的玻璃仪器有:烧杯、玻璃棒、_____________、__________。(在横线上填写所缺仪器的名称)
(4)鲜花保鲜剂中K+(蔗糖、阿司匹林中不含K+) 的物质的量浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算下列各题:
(1)在标准状况下,CO和CO2的混合气体共17.92L,质量为27.2g,则两种气体的物质的量之和为________ mol,其中CO2为________ mol,CO占总体积的________,混合气体的摩尔质量为________。
(2)在100mL混合酸的溶液中,硝酸的物质的量浓度为0.4mol/L,硫酸的物质的量浓度为0.2mol/L,向其中加入6.4g铜粉,微热,使其充分反应,生成NO在标准状况下的体积为
_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线:
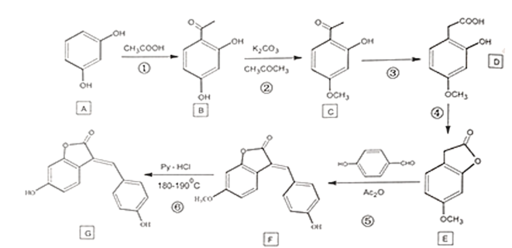
回答下列问题:
(1)A的化学名称为_________________。
(2)B中含有的官能团名称为_________________。
(3)下列有关G的说法中正确的是_________________。
A.常温下易溶于水
B.分子式为C15H9O4
C.可使酸性KMnO4溶液褪色
D.与NaOH反应时,lmolG最多消耗4mo1NaOH
(4)写出E到F的化学反应方程式_________________。
(5)⑥的反应类型为_________________。
(6)写出符合以下条件的D的同分异构体的结构简式_________________。
①能与NaHCO3溶液反应:
②能使FeCl3溶液变紫色:
③核磁共振氢谱峰面积比为1:1:2:6。
(7)设计由![]() 和
和![]() 为起始原料制备
为起始原料制备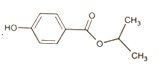 的合成路线(其他试剂任选)。_________________
的合成路线(其他试剂任选)。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步反应直接完成的是
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com