
【题目】为探究苯与溴的取代反应,甲用下图装置Ⅰ进行如下实验:
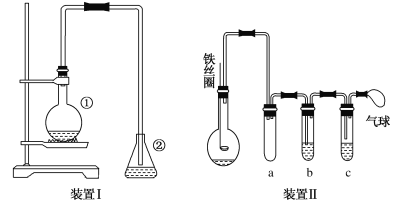
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑作催化剂,3~5分钟后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应。
(1)装置Ⅰ中①的化学方程式为__________________________。
(2)烧瓶中生成的红褐色油状液滴的成分是溴苯和溴单质,要想得到纯净的产物,可用NaOH溶液试剂洗涤。洗涤后分离粗产品应使用的仪器是________________。
(3)乙同学设计上图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是__________________。b中的试剂是___________________。比较两套装置,装置Ⅱ的主要优点__________________________。
【答案】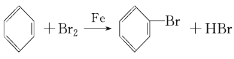 分液漏斗 防止倒吸 CCl4或
分液漏斗 防止倒吸 CCl4或![]() 防止倒吸;可以控制反应进行程度;避免杂质干扰;防止污染空气
防止倒吸;可以控制反应进行程度;避免杂质干扰;防止污染空气
【解析】
苯和液溴在铁作催化剂作用下发生反应生成溴苯和溴化氢,反应是放热反应,溴易挥发,生成的HBr和溴蒸汽进入后面装置,用苯或四氯化碳吸收溴蒸汽,HBr溶于水用硝酸银或紫色石蕊验证,从而得出苯和液溴反应是取代反应,生成的溴苯中溶有溴单质,因此用氢氧化钠溶液除去溴单质,再用分液漏斗分离得到溴苯。
(1)装置Ⅰ中①是苯和液溴发生取代反应生成溴苯和溴化氢,其化学方程式为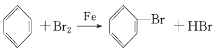 ;
;
故答案为: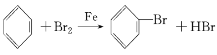 。
。
(2)溴苯是难溶于水的液体,因此洗涤后分离粗产品应使用的仪器是分液漏斗;
故答案为:分液漏斗。
(3)分析装置Ⅱ;由于反应是放热反应,溴易挥发,易溶于苯和四氯化碳,因此a的作用是防止溴和苯或四氯化碳溶解时发生倒吸进入到发生装置中,a起到安全瓶的作用;b中的试剂是苯或四氯化碳,吸收挥发的溴蒸汽,HBr进入到c中(盛放硝酸银溶液)验证发生取代反应,如果C装置内出现浅黄色沉淀,证明有溴化银生成,说明反应生成了溴化氢;比较两套装置,装置Ⅱ的主要优点防止倒吸,可以控制反应进行程度,避免杂质干扰,防止污染空气;
故答案为:防止倒吸;CCl4或![]() ;防止倒吸,可以控制反应进行程度,避免杂质干扰,防止污染空气。
;防止倒吸,可以控制反应进行程度,避免杂质干扰,防止污染空气。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】氯水中存在平衡Cl2+H2O![]() HCl+HClO,HClO
HCl+HClO,HClO![]() H++ClO-。达平衡后,要使HClO浓度增大,可加入( )
H++ClO-。达平衡后,要使HClO浓度增大,可加入( )
A.H2SB.NaHCO3C.盐酸D.NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+3B(g)===2C(g)+D(g),经2 min,B的浓度减少了0.6 mol/L。下列反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 mol/(L·min)
B.用C表示的反应速率是0.2 mol/(L·s)
C.2 min末的反应速率,用B表示是0.3 mol/(L·min)
D.2 min内,用B和C表示的反应速率之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,浓度均为1 mol·L-1的两种气体X2和Y2,在密闭容器中发生可逆反应生成气体Z。充分反应后,X2的浓度为0.4 mol·L-1,Y2的浓度为0.8 mol·L-1,生成气体Z的浓度为0.4 mol·L-1。则该反应的化学方程式(Z用X、Y表示)是( )
A.X2(g)+2Y2(g) ![]() 2XY2(g)
2XY2(g)
B.2X2(g)+Y2(g) ![]() 2X2Y(g)
2X2Y(g)
C.X2(g)+3Y2(g) ![]() 2XY3(g)
2XY3(g)
D.3X2(g)+Y2(g) ![]() 2X3Y(g)
2X3Y(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
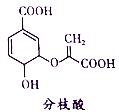
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各关系式中能说明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积增大
A. ①②B. ①③C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量A、B装入容积为1 L的恒温密闭容器中,发生反应:2A(g)+mB(g)![]() nC(g),1 min时达到平衡,C的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的1/2,达到新的平衡时C的浓度为1.8x mol·L-1。下列说法正确的是( )
nC(g),1 min时达到平衡,C的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的1/2,达到新的平衡时C的浓度为1.8x mol·L-1。下列说法正确的是( )
A.化学计量数的关系为2+m <n
B.容器的容积缩小,正反应速率增大,逆反应速率减小
C.原容器中用B表示的该反应在1min内的平均速率为![]() mol·(L·min)-1
mol·(L·min)-1
D.若保持温度和容器容积不变,充入氦气,平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com