解:Ⅰ.二氧化锰和浓盐酸反应制取氯气、氯化锰和水,反应的方程式为MnO
2+4HCl(浓)

MnCl
2+Cl
2↑+2H
2O,
故答案为:MnO
2+4HCl(浓)

MnCl
2+Cl
2↑+2H
2O;
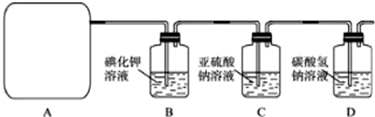
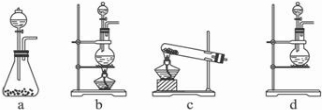
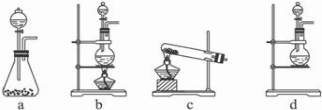
Ⅱ.(1)A部分用于制取Cl
2,根据所给Cl
2的生成反应的反应物状态和反应是否需要加热选择气体发生装置,应选属于“固+液

气”型的b,故答案为:b;
(2)Na
2SO
3氧化的产物为Na
2SO
4,确定存在SO
42-即可证明Na
2SO
3已部分被氧化.检验时,应取C中溶液少许于洁净试管中,先加稀HCl至不再产生气体以排除SO
32-的干扰,然后再加入BaCl
2溶液,若产生白色沉淀,则证明Na
2SO
3已部分被氧化,
故答案为:取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化;
(3)进入D的Cl
2与水反应的离子方程式为Cl
2+H
2O?H
++Cl
-+HClO,HCl能与NaHCO
3反应,离子方程式为H
++HCO
3-=CO
2↑+H
2O,HClO因酸性比H
2CO
3弱而不能与NaHCO
3反应,故答案为:Cl
2+H
2O═H
++Cl
-+HClO;H
++HCO
3-═CO
2↑+H
2O;
(4)NaHCO
3吸收Cl
2的能力有限,应将尾气通入NaOH溶液中,故答案为:应将尾气通入NaOH溶液中;
(5)关系式Ca(ClO)
2~2Cl
2~2I
2~4Na
2S
2O
3,
n[Ca(ClO)
2]=

n(Na
2S
2O
3)=20.0 mL×10
-3 L?mL
-1×0.1 mol?L
-1×
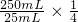
=0.005 mol,
Ca(ClO)
2%=
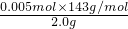
×100%=35.75%,
故答案为:35.75%.
分析:Ⅰ.二氧化锰和浓盐酸反应制取氯气、氯化锰和水,以此书写化学方程式;
Ⅱ.(1)根据反应物的状态及反应条件选择发生装置;
(2)氯气有强氧化性,亚硫酸根离子有还原性,所以氯气和亚硫酸根离子能发生氧化还原反应生成硫酸根离子、氯离子和氢离子;如果亚硫酸钠被氧化会生成硫酸钠,根据硫酸根离子的检验方法检验即可;
(3)氯气和水反应生成盐酸和次氯酸,盐酸能和碳酸氢根离子反应生成二氧化碳;
(4)氯气有刺激性气味,尾气不能直接排空,要用尾气处理装置处理;
(5)可利用关系式计算.
点评:本题考查较为综合,题目难度中等,注意亚硫酸根离子的检验首先要排除硫酸根离子的干扰,易错点为(5),注意根据关系式法计算.

 2CaSO4+2Cl2↑+2H2O
2CaSO4+2Cl2↑+2H2O
 MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O, MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O; 气”型的b,故答案为:b;
气”型的b,故答案为:b; n(Na2S2O3)=20.0 mL×10-3 L?mL-1×0.1 mol?L-1×
n(Na2S2O3)=20.0 mL×10-3 L?mL-1×0.1 mol?L-1×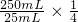 =0.005 mol,
=0.005 mol,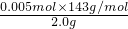 ×100%=35.75%,
×100%=35.75%,

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案