
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 25.02 | 24.22 | 24.18 |


科目:高中化学 来源:不详 题型:单选题
| A.两者对应反应的△H均小于0 |
| B.两者的单位均为kJ/mol,但mol-1的含义不同 |
| C.两者的数值均不随反应物用量改变而改变 |
| D.两者的数值均随反应物改变而改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.该中和滴定过程,最宜用石蕊作指示剂 |
B.图中点②所示溶液中, |
| C.图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 |
D.滴定过程中的某点,会有 的关系存在 的关系存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钠米金属燃料,更易点燃 |
| B.铁作燃料时,可用磁性材料吸引生成物,便于产物分离 |
| C.镁可以通过2Mg+CO2=2MgO+C,达到既节能减碳又释放能量的效果 |
| D.可从海水中提取氯化镁,并使氯化镁分解获得镁并释放出能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向纯水中加入少量CH3COONa固体,促进了水的电离 |
| B.25°C 时,pH=3的醋酸与pH=3的HCl对水的电离抑制作用相同 |
| C.25°C时,pH=3的NH4Cl溶液中,水电离出的c(H+)是10-3mol/L |
| D.升高温度,纯水电离出的c(H+)增大,pH减少,显酸性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
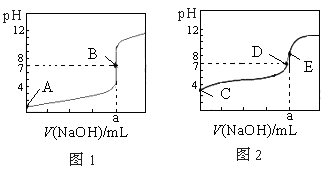
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是( )
SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是( )| A.该滴定反应可以表示为:SO32-+SO2+=2SO2 |
| B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数 |
| C.自离解的存在,说明SO2是离子化合物 |
| D.可通过导电能力变化来判断是否到达滴定终点 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该溶液一定呈酸性 |
| B.该溶液一定呈碱性 |
| C.该溶液的pH可能约为1 |
| D.该溶液的pH可能约为13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com