
【题目】肉桂酸为微有桂皮香气的无色针状晶体,能抑制黑色酪氨酸酶的形成,是高级防晒霜中不可少的成分之一。实验室制取肉桂酸的原理如下:

实验步骤:
步骤1 在图1所示装置(夹持与加热仪器未画出,下同)的三颈烧瓶内加入K2CO3、苯甲醛(油状物)和乙酸酐,混合均匀后,在170 ℃~180 ℃加热反应1 h,冷却。
 图1
图1  图2
图2  图3
图3
步骤2 向三颈烧瓶内分批加入20 mL水和Na2CO3固体,调节溶液pH约为8。
步骤3 在三颈烧瓶中加入活性炭,用图2所示水蒸气蒸馏装置蒸馏除去未反应的苯甲醛。
步骤4 将三颈烧瓶内反应混合物趁热过滤,滤液冷却至室温,用浓盐酸酸化至pH=3,析出大量晶体,抽滤。并用少量冷水洗涤晶体。
步骤5 将晶体在图3所示热水浴上加热干燥。
(1)图1中仪器A的作用是____________。
(2)步骤2中Na2CO3需分批加入的原因是_________________________________________________。
(3)水蒸气蒸馏时,判断蒸馏结束的方法是________。
(4)步骤4中,“趁热过滤”的目的是_____________。
(5)抽滤时所需主要仪器有____、安全瓶及抽气泵等。
(6)与使用烘箱烘干相比,热水浴干燥的优点是___________________________________。
【答案】(利用空气)冷凝回流,提高原料利用率 防止加入太快,产生大量CO2气体,可能会将反应液冲出,且不利于pH测定 馏出液澄清透明或取少量馏出液滴入水中,无油珠存在 除去固体杂质,防止肉桂酸结晶析出 布氏漏斗、抽滤瓶 防止温度过高产品变质
【解析】
(1)根据仪器的结构可知,图1中仪器A的作用是(利用空气)冷凝回流,提高原料利用率;
(2)步骤2中Na2CO3需分批加入的原因是防止加入太快,产生大量CO2气体,可能会将反应液冲出,且不利于pH测定;
(3)水蒸气蒸馏时,馏出液澄清透明或取少量馏出液滴入水中,无油珠存在,则可判断蒸馏结束;
(4)步骤4中,“趁热过滤”的目的是除去固体杂质,防止肉桂酸结晶析出;
(5)抽滤时所需主要仪器有布氏漏斗、抽滤瓶、安全瓶及抽气泵等。
(6)与使用烘箱烘干相比,热水浴干燥的优点是防止温度过高产品变质。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应:2SO2(g)+ O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2mol SO2 1molO2 | 4mol SO3 | 2molSO2 1mol O2 |
平衡v正(SO2) mol/(L·s) | v1 | v2 | v3 |
平衡c(SO3) mol/L | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | a1(SO2) | a2(SO3) | a3(SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法不正确的是
A. v1< v2,c2< 2c1 B. v1< v3,α1(SO2 ) >α3(SO2 )
C. K1> K3,p2> 2p3 D. c2> 2c3,α2(SO3 )+α3(SO2 )<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种“既热即食型”快餐适合外出旅行时使用,它是利用两种物质发生化学反应对食物进行加热,这两种化学物质最适合选择的是( )
A. 浓硫酸与水B. 氢氧化钠与水C. 生石灰与水D. 氯化钠与水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。
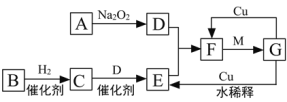
(1)物质G的化学式:__________________。
(2)物质B的名称:____________________。
(3)写出A→D的化学方程式:_______________________________________________;
F→G的化学方程式:______________________________________________________;
G→E的离子方程式:______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应起了氮的固定作用的是( )
A. 氨经催化氧化生成NOB. NO与O2反应生成NO2
C. N2在一定条件下与Mg反应生成Mg3N2D. NH3与硝酸反应生成NH4NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语填空:
(1)2个硫酸根离子________;
(2)2个镁原子_______;
(3)氧化铁中铁元素的化合价 ___________;
(4)3个氮分子_________;
(5)人体中含量最高的金属元素是_____________.
(6)在焙制糕点时常需加入一种名为“泡打粉”的膨松剂,俗称小苏打 .其主要成分是_________________(填化学式)
(7)吸烟有害健康,烟草燃烧时产生的烟气中含有一种能与血红蛋白结合的有毒气体,它是___________(填化学式).
(8)乙醇(C2H5OH),乙醇是一种清洁能源,其燃烧的化学方程式为:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过实验探究发现化学反应中的某种规律,再寻求理论上的科学合理解释,是化学工作者的重要研究方法。
I.在体积可变的密闭容器中投入1 mol CO和2molH2,不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。

(1)M点H2的转化率为___________;反应速率N点v正(CO)___________M点ν逆(CO)(填“>”“<”或“=”)
(2)若M点对应混合气体的体积为1L,则506K时,该反应平衡常数K=___________(保留三位小数)。图表示平衡常数的对数(lgK)与温度的关系,B、C点中能正确表示该反应的lgK与T的关系的点为___________。

(3)在2L恒容密闭容器中充入 a mol H2、2 mol CO和7.4 mol CH3OH(g),在506K下进行上述反应。为了使该反应逆向进行,a的取值范围为___________。
Ⅱ.砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知H3AsO4的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(已知:pKa=-lgKa)。
回答下列问题:
(4)NaH2AsO4溶液呈___________(填酸性”、“中性”或“碱性”),试通过计算说明___________。
(5)某小组同学欲探究可逆反应AsO33-+I2+2OH-![]() AsO43-+2I-+H2O,设计如图所示装置。加入试剂并连接裝置,电流由C2流入C1。当电流变为零时,向装置左边烧杯中逐滴加入一定量2 mol/L HCl,发现又产生电流,实验中电流与时间的关系如图所示。
AsO43-+2I-+H2O,设计如图所示装置。加入试剂并连接裝置,电流由C2流入C1。当电流变为零时,向装置左边烧杯中逐滴加入一定量2 mol/L HCl,发现又产生电流,实验中电流与时间的关系如图所示。

写出图4中c点对应的正极反应式___________,能判断该反应达到平衡状态的是___________。
a.2v(I-)正=v(AsO33-)逆 b.溶液pH不再变化
c.电流表示数变为零 d.右边烧杯中c(K+)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com