
A、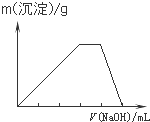 |
B、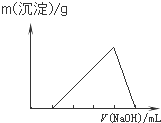 |
C、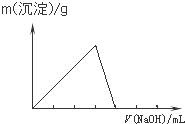 |
D、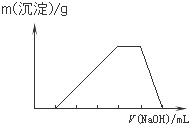 |


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、摩尔质量 | B、密度 |
| C、质量 | D、分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、35.5a=(W2-W1)V2 | ||
B、n(Al)>
| ||
C、n(Na)+3n(Al)=
| ||
D、aV2=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①③④ |
| C、②④⑤ | D、②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠受热易分解,可用于生产食品发酵粉 |
| B、次氯酸钠具有强氧化性,可用于配制消毒液 |
| C、二氧化硅不与强酸反应,可用石英玻璃容器盛放氢氟酸 |
| D、二氧化硫有漂白、杀菌性能,可在食品生产中大量使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| a | b | c | d | |
| A | Cu | CuSO4 | Cu(OH)2 | Cu2O |
| B | N2 | NO2 | HNO3 | NO |
| C | CH3OH | HCHO | HCOOH | HCOOCH3 |
| D | Fe | FeCl3 | Fe(OH)3 | Fe2O3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com