
科目:高中化学 来源: 题型:阅读理解
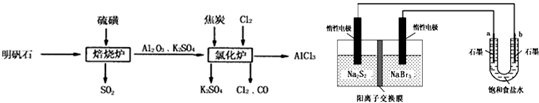
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 金属铝是应用广泛的金属之一,在工农业生产中有着广泛的应用,对金属制品进行抗腐蚀处理,可延长其使用寿命.
金属铝是应用广泛的金属之一,在工农业生产中有着广泛的应用,对金属制品进行抗腐蚀处理,可延长其使用寿命.查看答案和解析>>
科目:高中化学 来源:山东省模拟题 题型:填空题
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(1)分析该反应并回答下列问题:
①平衡常数表达式为K=____________。
②下列各项中,不能说明该反应已达到平衡的是________(填序号)。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗2 mol CO,同时生成1 mol CH3OH
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。
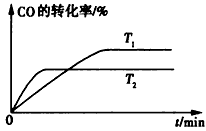
①该反应的焓变△H____(填“>”、“<”或 “=”)0。
②T1和T2温度下的平衡常数大小关系是K1____ (填“>”、“<”或“=”)K2。
③若容器容积不变,下列措施可增加甲醇产率的是____
a.升高温度
b.将CH3OH(g)从体系中分离出来
c.使用合适的催化剂
d.充入He,使体系总压强增大
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-a kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=-b kJ/mol
③H2O(g)=H2O(l) △H=-c kJ/mol
则CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H =____kJ/mol。
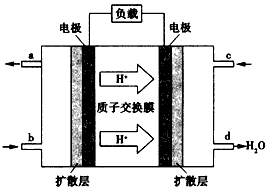
(4)已知甲醇燃料电池的工作原理如图所示。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知:BaSO4(s) + 4C(s) = 4CO(g) + BaS(s);△H1 =571.2kJ/mol,
BaSO4(s) + 2C(s) = 2CO2(g) + BaS(s);△H2= 226.2 kJ/mol。
则反应C(s) + CO2(g) = 2CO(g)的△H3= kJ/mol。
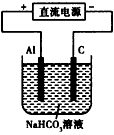
(2)下图所示装置工作时均与H2有关。

①图1所示装置中,通入H2的管口是 (选填字母代号)。
②某同学按图2所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色。该同学据此得出结论:铁与水蒸气反应生成FeO和H2。该结论 (填“严密”或“不严密”),你的理由是 (用离子方程式和必要的文字说明)。
(3)CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为 。
(4)某稀硫酸和稀硝酸的混合溶液200 mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。

则BC段气体是产生的气体是 ;OA段离子反应方程式为 , c(H2SO4)为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com