
【题目】七种短周期主族元素①~⑦,其原子序数依次增大,②元素是地壳中含量最多的,⑤元素为两性元素,④⑦两元素组成的化合物是我们日常生活必须的调味品,②和⑥元素的原子序数之和是①和④两元素原子序数之和的两倍。请用化学用语回答下列问题:
(1)③、⑤、⑥的简单离子半径由大到小的顺序为_______________________。
(2)⑥和⑦的最高价氧化物对应的水化物的酸性强弱为___________>___________。
(3)写出二氧化硅与含上述某种元素的酸反应的化学方程式_________________。
(4)由⑤和空气、海水构成的原电池中,其正极反应式为_____________________。
(5)由上述元素形成的物质可发生下图中的反应,其中B、C、G 是单质,B为黄绿色气体。
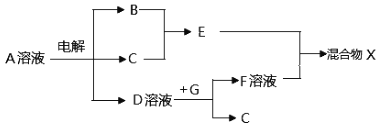
①写出D溶液与G反应的化学方程式________________________________。
②混合物X中的某物质不溶于水,但既能溶于酸又能溶于碱,写出能解释它在苛性钠溶液中发生反应的原因的电离方程式_________________________________。
③写出电解A溶液的离子方程式_______________________________。
【答案】 S2->F - >Al3+ HClO4 H2SO4 SiO2+4HF = SiF4↑+2H2O O2+4e- +2H2O=4OH- 2Al+2NaOH +2H2O =2NaAlO2+3H2↑ Al(OH)3![]() AlO2-+H++H2O 2Cl-+2H2O
AlO2-+H++H2O 2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
【解析】②元素是地壳中含量最多的所以②是O;⑤元素为两性元素则⑤为Al;④⑦两元素组成的化合物是我们日常生活必须的调味品知④为Na; ⑦为Cl;②和⑥元素的原子序数之和是①和④两元素原子序数之和的两倍知⑥为S; 七种短周期主族元素①~⑦,其原子序数依次增大知③为F。根据上述分析(1)③、⑤、⑥的简单离子半径由大到小的顺序为S2->F - >Al3+。
(2)⑥和⑦的最高价氧化物对应的水化物的酸性强弱为HClO4 >. H2SO4。
(3)二氧化硅是酸性氧化物,能与HF发生反应,其反应的化学方程式SiO2+4HF = SiF4↑+2H2O。
(4)由⑤是Al和空气、海水构成的原电池中,Al做负极,正极为O2发生还原反应,其正极反应式为O2+4e- +2H2O=4OH-。
(5) B为黄绿色气体知B为Cl2,电解A得三种物质,由图知A为NaCl,C为氢气,D为氢氧化钠溶液,G为Al,F为偏铝酸钠溶液,E为盐酸,X为氢氧化铝溶液氯化铝溶液。所以①D溶液与G反应的化学方程式2Al+2NaOH +2H2O =2NaAlO2+3H2↑。
②氢氧化铝溶不溶于水,既能溶于酸又能溶于碱,是因为存在Al(OH)3![]() AlO2-+H++H2O
AlO2-+H++H2O
加苛性钠溶液促进电离,所以能溶于碱液中。答案:Al(OH)3![]() AlO2-+H++H2O。
AlO2-+H++H2O。
③写出电解A为NaCl溶液,电解反应的离子方程式为2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-


科目:高中化学 来源: 题型:
【题目】(1)下列物质:①.Cu ②.NaCl晶体 ③.NaHSO4 ④.CO2 ⑤.CaO ⑥HCl ⑦.稀H2SO4 ⑧. 熔融Ba(OH)2 ⑨.C2H5OH ⑩.NaCl溶液。
属于电解质的是(填序号,下同)_____,属于非电解质的是_____,能导电的是______。
(2)写出下列物质在水溶液中的电离方程式:
①NaHSO4 ___________________________;
②Al2(SO4)3 ________________________________;
③NH4NO3 ________________________。
(3)按要求写出下列方程式:
①写出硫酸铜溶液中滴加氢氧化钠溶液的反应的离子方程式:_____________。
②写出能用离子方程式CO32-+2H+=CO2↑+H2O表示的一个化学方程式:__________。
【答案】②③⑤⑥⑧ ④⑨ ①⑦⑧⑩ NaHSO4=Na++H++SO42- Al2(SO4)3=2Al3++3SO42- NH4NO3=NH4++NO3- Cu2++2OH-==Cu(OH)2↓ Na2CO3+2HCl=2NaCl+CO2↑+H2O(或其他)
【解析】
(1)在水溶液里或熔化状态下能够自身电离出离子的化合物是电解质,属于电解质的是NaCl晶体、NaHSO4、CaO、HCl、熔融Ba(OH)2,答案选②③⑤⑥⑧;在水溶液里和熔融状态下都不能自身电离出离子的化合物是非电解质,属于非电解质的是CO2、C2H5OH,答案选④⑨;含有自由移动电子或离子的物质可以导电,能导电的是Cu、稀H2SO4、熔融Ba(OH)2、NaCl溶液,答案选①⑦⑧⑩;(2)①NaHSO4在水溶液中的电离方程式为NaHSO4=Na++H++SO42-;②Al2(SO4)3在水溶液中的电离方程式为Al2(SO4)3=2Al3++3SO42-;③NH4NO3在水溶液中的电离方程式为NH4NO3=NH4++NO3-。(3)①硫酸铜溶液中滴加氢氧化钠溶液生成氢氧化铜沉淀和硫酸钠,反应的离子方程式为Cu2++2OH-==Cu(OH)2↓:②能用离子方程式CO32-+2H+=CO2↑+H2O表示的一个化学方程式可以是Na2CO3+2HCl=2NaCl+CO2↑+H2O。
点睛:化合物在水溶液中或受热熔化时本身能否发生电离是区别电解质与非电解质的理论依据,能否导电则是实验依据。因此能导电的物质不一定是电解质,如石墨;电解质本身不一定能导电,如NaCl晶体。
【题型】填空题
【结束】
27
【题目】为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。
(1)往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色A________,B____________。
(2)写出上述过程中有关反应的化学方程式:
Fe2O3→A_______________________;A→B____________________________。
(3)B→C可看到的现象是___________________________________________。
(4)将A的饱和溶液滴入沸水中并不断加热,可制得_______________胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为___________效应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁。某化学兴趣小组对绿矾的某一性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化,再向试管中通入氯气,溶液逐渐变红。由此可知硫酸亚铁的一些性质为:_________;此过程中涉及的反应离子方程式为_______________。
(2)为探究硫酸亚铁的分解产物,无水硫酸亚铁固体置于装置A中,打开K1和K2,缓缓通入N2,加热。实验后反应管A中残留固体为红色粉末。
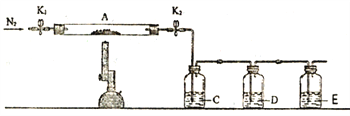
①C、D、E中的溶液依次为_______(填标号)。C、D中有气泡冒出,C、D中还可观察到的现象分别为________、________。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出装置A中反应的化学方程式_____________。
③装置E的作用_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行了如图所示的实验,下列说法中错误的是
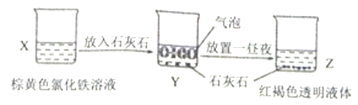
A. X、Z烧杯中分散质相同
B. 利用过滤的方法,可将Z中固体与液体分离
C. Y中反应的离子方程式为:3CaCO3+2Fe3++3H2O=2Fe(OH)3(胶体)+3CO2↑+3Ca2+
D. Z中的分散系能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向淀粉溶液中加入少量稀H2SO4,加热使淀粉发生了水解反应,为测定其水解程度,所需的试剂是
①银氨溶液 ②新制Cu(OH)2悬浊液 ③NaOH溶液 ④碘水 ⑤BaCl2
A. ①⑤ B. ②④ C. ①②④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】党的十九大报告提出“加快生态文明体制改革,建设美丽中国”,发展清洁能源对建设美丽中国具有重要意义。氢能是一种高效清洁、极具发展潜力的能源。
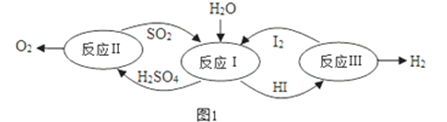
(1)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图1所示:
①反应Ⅰ的离子方程式是______________________________________________;反应Ⅰ得到的产物用I2进行分离,该产物的溶液在过量I2的存在下会分成两层:含低浓度I2的H2SO4层和含高浓度I2的HI层。经离子浓度检测,H2SO4溶液层中c(H+):c(SO42-)=2.06:1,其比值大于2的原因是 _______________________ 。
②反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+ 2H2O(g)△H = +550kJmo1-1,它由两步反应组成:ⅰ.H2SO4(l)=SO3(g)+ H2O(g)△H = +177kJmo1-1,ⅱ.SO3(g)分解,写出SO3(g)分解的热化学方程式 ______________________________。
(2)工业上利用反应C(s)+2H2O(g)![]() CO2(g)+2H2(g) △H>0 也可制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,其相关数据如表所示:
CO2(g)+2H2(g) △H>0 也可制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,其相关数据如表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | |
C(s) | H2O(g) | H2(g) | |||
甲 | 2 | T1 | 2 | 4 | 3.2 |
乙 | 1 | T2 | 1 | 2 | 1.2 |
①T1℃时,该反应的平衡常数K= ______ ;T1 ______ T2(填“>”、“=”或“<”);
②若乙容器中达到平衡所需时间为3min,则当反应进行到1.5min时,H2O(g)的物质的量浓度 ______(填选项字母)。
A.=1.4mol/L B.<1.4mol/L C.>1.4mol/L
(3)工业上还可采用电化学法利用H2S废气制取氢气,该法制氢过程的示意图如图所示,
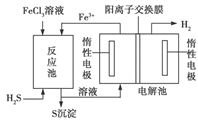
①反应池中反应物的流向采用气、液逆流方式,其目的是____________________;
②反应池中发生反应后的溶液进入电解池,电解总反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示化合物的说法不正确的是
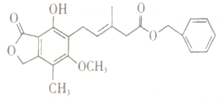
A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
C. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
D. 该化合物与足量NaOH反应可生成化学式为C16H17O7Na3的化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com