
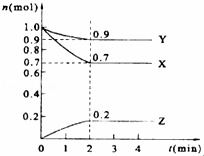
某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.
(1)由图中所给数据进行分析,该反应的化学方程式为 .
(2)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为 .
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),n始:n平= 10 .
(4)达到平衡时,X和Y的转化率之比,α(X):α(Y)= .
(5)平衡时,Z的体积分数为 (保留两位有效数字).
(6)反应达到平衡后,下列措施能加快化学反应速率的有 (填序号,多选或少选无分).
A.增大反应物的浓度 B.升高温度 C.使用正催化剂
(7)下列叙述能说明上述反应达到平衡状态的是 (填序号,多选或少选无分).
A.X、Y、Z的物质的量之比为3:1:2
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol X,同时生成2mol Z
D.混合气体的总质量不随时间的变化而变化
E.混合气体的总物质的量不随时间的变化而变.
考点: 化学平衡的计算;化学反应速率的影响因素;化学平衡状态的判断.
分析: (1)判断出反应物和生成物,根据物质的量变化之比等于化学剂量数之比确定反应的化学方程式;
(2)根据v=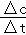 计算反应速率;
计算反应速率;
(3)在相同温度下,依据图象计算起始气体物质的量和平衡状态气体物质的量,得到原混合气体与平衡混合气体的总物质的量之比;
(4)转化率= ×100%;
×100%;
(5)反应达平衡时,气体的总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol,Z物质的量0.2mol,计算平衡时Z的体积分数;
(6)根据影响化学反应速率的影响条件分析,改变条件平衡向减弱这种改变的方向进行;
(7)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答: 解:(1)在反应中,X、Y的物质的量逐渐减小,Z的物质的量逐渐增大,则X、Y为反应物,Z为生成物,相同时间内物质的量的变化比值为:c(Y):c(X):c(Z)=(1.0﹣0.9):(1.0﹣0.7):0.2=1:3:2,化学反应中物质的量变化之比等于化学剂量数之比,则化学方程式为Y+3X⇌2Z,
故答案为:Y+3X⇌2Z;
(2)反应开始至2min,气体Z的平均反应速率为v=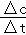 =
=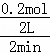 =0.05mol/(L.min),故答案为:0.05mol/(L.min);
=0.05mol/(L.min),故答案为:0.05mol/(L.min);
(3)反应达平衡时,气体的总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol,
起始时气体的总物质的量为:1.0mol+1.0mol=2.0mol,
原混合气体与平衡混合气体的总物质的量之比=2.0:1.8=10:9,
故答案为:10:9;
(4)X转化率= ×100%=
×100%=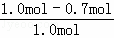 ×100%=30%
×100%=30%
Y转化率= ×100%=
×100%=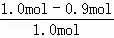 ×100%=10%
×100%=10%
达到平衡时,X和Y的转化率之比,α(X):α(Y)=30%:10%=3:1,
故答案为:3:1;
(5)反应达平衡时,气体的总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol,Z物质的量0.2mol,平衡时,Z的体积分数=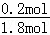 ×100%=11.1%,
×100%=11.1%,
故答案为:11.1%;
(6)2min末达到化学平衡状态;增大反应物的浓度、升高温度、使用正催化剂都可以加快化学反应速率,故答案为:ABC;
(7)A、物质的量之比为1:3:2,而不是量之比不变,不能说明反应达到平衡状态,故A错误;
B、反应前后气体体积分数变化,混合气体的压强不随时间的变化而变化,三者的浓度不再变化,达到了平衡,故B正确;
C、单位时间内生成2mol Z,则要消耗3mol X,未体现正与逆的关系,不能说明是否达到平衡,故C错误;
D.反应前后气体质量始终不变,混合气体的总质量不随时间的变化而变化,不能说明反应达到平衡状态,故D错误;
E.反应前后气体物质的量分数改变,当混合气体的总物质的量不随时间的变化而变,说明反应达到平衡状态,故E正确;
故选BE.
点评: 本题考查了化学平衡影响因素分析,平衡计算应用,该题通过图象中物质的物质的量的变化,来考查化学平衡的移动、化学反应速率计算,综合考查学生对知识的综合应用能力,题目难度中等.


科目:高中化学 来源: 题型:
在一定的温度和压强下,气体体积的大小主要取决于( )
|
| A. | 气体分子数目的多少 |
|
| B. | 气体分子的相对分子质量大小 |
|
| C. | 气体分子间距离的大小 |
|
| D. | 构成气体分子的原子的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是( )
A.
4 5 6
12 13
B.
2
8
16 17 18
C.
1 2
11
19
D.
4
10 11 12
20
查看答案和解析>>
科目:高中化学 来源: 题型:
有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 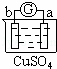
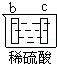
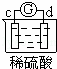
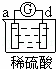
部分实验现象 a极质量减小
b极质量增加 b极有气体产生
c极无变化 d极溶解
c极有气体产生 电流计指示在导线中
电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A. a>b>c>d B. b>c>d>a C. d>a>b>c D. a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在一定条件下,2mol H2完全燃烧生成液态水时放出热量572kJ,请回答下列问题:
(1)反应物的总能量 (填“>”、“<”或“=”)生成物的总能量;
(2)在此条件下,若反应生成含1molO﹣H键的液态水,则放出热量为 kJ;
(3)若2mol氢气完全燃烧生成水蒸气,则放出的热量 (填“>”、“<”或“=”)572kJ.
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A(C4H8Br2)可由下列反应制得,C4H10O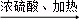 C4H8
C4H8 C4H8Br2,则A的结构式不可能的是( )
C4H8Br2,则A的结构式不可能的是( )
A. CH3CH2CHBrCH2Br B. CH3CH(CH2Br)2
C. CH3CHBrCHBrCH3 D. (CH3)2CBrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的分类正确的是( )
①混合物:水玻璃、水银、水煤气
②电解质:明矾、冰醋酸、石膏
③酸性氧化物:CO2、CO、SO3
④同位素:1H、2H2、3H
⑤同素异形体:C80、金刚石、石墨
⑥干冰、液氯都是非电解质.
A. ①②③④⑤⑥ B. ②④⑤⑥ C. ②⑤⑥ D. ②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 需要加热才能发生的反应一定是吸热反应 |
|
| B. | 放热反应在常温条件一定能自动发生的 |
|
| C. | 反应物和生成物所具有的总能量决定反应放热还是吸热 |
|
| D. | 吸热反应在常温下一定不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)现有ag某气体AB2,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:该气体的物质的量为_____mol;该气体所含原子总数为 个; 该气体在标准状况下的体积为____________L。该气体一个分子的质量为 g。
该气体在标准状况下的体积为____________L。该气体一个分子的质量为 g。
(2)805g Na2SO4·10H2O中所含的Na+的物质的量是 、SO42—的物质的量是 ,所含H2O分子的数目是 个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com