
������������Ǻ���һ�����һ�������ˮƽ����Ҫ��־��
��1��һ�������£�SO2�������Ӧ10 min��SO2��SO3���ʵ���Ũ�ȷֱ�Ϊ1.2 mol/L��2.0 mol/L����SO2��ʼ���ʵ���Ũ��Ϊ______������SO3�Ļ�ѧ��Ӧ����Ϊ______��
��2�����ı��������������SO2�������Ӧ����SO3��ʹ10 min�ڵ���O2��ʾ�ķ�Ӧ����Ϊ0.15mol/(L��min)����ı������������_______________��
| A��ѹ�����������ѹǿ | B�������¶� | C����������ĵ��� | D��������SO2��Ũ�� |
(1) 3.2 mol/L 0.2 mol/(L��min) ��(2) A D �� (3) SO2 + 2NH3��H2O = 2NH4��+ SO32��+ H2O
���������������1�����ݷ�Ӧ����ʽ2SO2(g) +O2(g) 2SO3(g)��֪������SO3���ʵ���Ũ����2.0 mol/L�������ĵ�SO2�����ʵ���Ũ����2.0 mol/L����ʱ������SO2 1.2 mol/L�����Կ�ʼʱSO2�����ʵ���Ũ���ǣ�2.0 +1.2��mol/L="3.2mol/L." ����SO3�Ļ�ѧ��Ӧ����ΪV(SO3)=��c�¦�t="2.0" mol/L��10 min=" 0.2" mol/(L��min)����2��V(O2): V(SO3)=1:2������V(O2)= 0.1mol/(L��min).�������ı�����ʹV(O2)=" 0.15" mol/(L��min)��A��ѹ�����������ѹǿ����ʹ���ʵ�Ũ�������ܴﵽV(O2)= 0.1mol/(L��min)����ȷ��B���������¶ȣ���Ӧ���ʼ���������C����������ĵ����������������ݻ����䣬������ʵķ�Ӧ���ʲ��䡣����D��������SO2��Ũ�ȣ�����Ӧ���Ũ�Ȼ�ѧ��Ӧ���ʼӿ죬��ȷ����ѡ��ΪA��D����3��SO2������������ܹ�������Ӧ�����κ�ˮ������ڹ�ҵ�����ᣬ�����ù����İ�ˮ��SO2β�����������õ����Σ������Ӧ�����ӷ���ʽ��SO2 + 2NH3��H2O = 2NH4��+ SO32��+ H2O��
2SO3(g)��֪������SO3���ʵ���Ũ����2.0 mol/L�������ĵ�SO2�����ʵ���Ũ����2.0 mol/L����ʱ������SO2 1.2 mol/L�����Կ�ʼʱSO2�����ʵ���Ũ���ǣ�2.0 +1.2��mol/L="3.2mol/L." ����SO3�Ļ�ѧ��Ӧ����ΪV(SO3)=��c�¦�t="2.0" mol/L��10 min=" 0.2" mol/(L��min)����2��V(O2): V(SO3)=1:2������V(O2)= 0.1mol/(L��min).�������ı�����ʹV(O2)=" 0.15" mol/(L��min)��A��ѹ�����������ѹǿ����ʹ���ʵ�Ũ�������ܴﵽV(O2)= 0.1mol/(L��min)����ȷ��B���������¶ȣ���Ӧ���ʼ���������C����������ĵ����������������ݻ����䣬������ʵķ�Ӧ���ʲ��䡣����D��������SO2��Ũ�ȣ�����Ӧ���Ũ�Ȼ�ѧ��Ӧ���ʼӿ죬��ȷ����ѡ��ΪA��D����3��SO2������������ܹ�������Ӧ�����κ�ˮ������ڹ�ҵ�����ᣬ�����ù����İ�ˮ��SO2β�����������õ����Σ������Ӧ�����ӷ���ʽ��SO2 + 2NH3��H2O = 2NH4��+ SO32��+ H2O��
���㣺���黯ѧ��Ӧ�в�ͬ���ʼ��Ũ�ȹ�ϵ����ѧ��Ӧ���ʵļ����Ӱ�����ء����ӷ���ʽ����д��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(7��)��һ���ܱ������У���һ�����ҿɻ������壬���߷ֱ���п��淴Ӧ�������ʵ������£�M��N��PΪ2.5mol��3.0mol��1.0mol��A��C��D��Ϊ0.50mol��B�����ʵ���Ϊx����x�����ʵ�����һ����Χ�ڱ仯��������ͨ�����ڷ�Ӧ�����¶ȣ�ʹ���෴Ӧ���ﵽƽ�⣬�Ҹ����ڷ�Ӧ��������λ�á��ﵽƽ����M��ת����Ϊ75%����д�հף�
��1���ﵽƽ���Ӧ�����������ܵ����ʵ���Ϊ mol��
��2����Ҫʹ���ҷ�Ӧ��ʼʱV��>V����x��ȡֵ��Χ ��
��3����Ҫʹ���ҷ�Ӧ��ʼʱV��<V����x��ȡֵ��Χ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��5�֣�������ũҵ������ҵ���к���Ҫ�����ã���ʷ��ŵ������ѧ��������3�ΰ���о������������ϳɰ��Ļ�ѧ�ҡ�
��1����ͼ��ʾ�¶�ΪT Kʱ�����������ϳɰ���Ӧ�����е������仯�� д���÷�Ӧ���Ȼ�ѧ����ʽ ��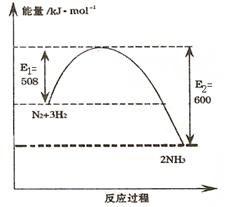
��2����֪��TK�¶��ºϳɰ���Ӧ��2.00L���ܱ������н��С��õ��������ݣ�
| ʱ�䣨h�� ���ʵ�����mol�� | | 0 | 1 | 2 | 3 | 4 |
| N2 | | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
 2NH3�Ļ�ѧƽ�ⳣ��K = ��������λС������
2NH3�Ļ�ѧƽ�ⳣ��K = ��������λС�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��14�֣���������Ҫ������Դ��������Ϊ�������õĹؼ��������ǵ�ǰ��ע���ȵ�֮һ��
��1�������������Դ����ȼ�ղ���Ϊ__________��
��2��NaBH4��һ����Ҫ�Ĵ������壬����ˮ��Ӧ�ﵽNaBO2���ҷ�Ӧǰ��B�Ļ��ϼ۲��䣬�÷�Ӧ�Ļ�ѧ����ʽΪ___________����Ӧ����1mol NaBH4ʱת�Ƶĵ�����ĿΪ__________��
��3������ɽ����л�������û�����ͱ�֮��Ŀ��淴Ӧ��ʵ������ͼ��⣺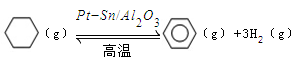 ��ij�¶��£�������ܱ������м��뻷���飬��ʼŨ��Ϊa mol/L��ƽ��ʱ����Ũ��Ϊbmol/L���÷�Ӧ��ƽ�ⳣ��K��_____��
��ij�¶��£�������ܱ������м��뻷���飬��ʼŨ��Ϊa mol/L��ƽ��ʱ����Ũ��Ϊbmol/L���÷�Ӧ��ƽ�ⳣ��K��_____��
��4��һ�������£���11ͼʾװ�ÿ�ʵ���л���ĵ绯ѧ���⣨���������л����
�ٵ����е����ƶ�����Ϊ____________��
������Ŀ�����ĵ缫��ӦʽΪ_________��
�۸ô���װ�õĵ���Ч��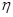 ��_____��
��_____�� ��
�� ��100%������������С�����1λ��
��100%������������С�����1λ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��14�֣�����KMnO4��Һ������ᣨH2C2O4����Һ��Ӧ��ij̽��С�����÷�Ӧ��������Һ��ɫ��ʧ�����ķ������о�Ӱ�췴Ӧ���ʵ����ء�
��.ʵ��ǰ������Ũ��Ϊ0.1000mol?L-1����KMnO4����Һ�ζ�δ֪Ũ�ȵIJ��ᡣ
��1��д���ζ������з�����Ӧ�Ļ�ѧ����ʽΪ ��
��2���ζ������в����ζ��ܵ�ͼʾ��ȷ���� ��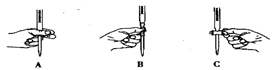
��3�����ζ�ǰ�ζ��ܼ��촦�����ݣ��ζ�����ʧ����ʹ��õIJ�����ҺŨ�� ���ƫ�ߡ�����ƫ�͡������䡱����
��.ͨ���ζ�ʵ��õ�������Һ��Ũ��Ϊ0.2000mol��L-1 ���øò�����Һ���±����к���ʵ�飨ÿ��ʵ�������Һ��������Ϊ8mL����
��4��д������a ��Ӧ��ʵ��Ŀ�� ����50��Cʱ������Ũ��c(H2C2O4)�淴Ӧʱ��t�ı仯���� ����ͼ��ʾ�����������������䣬����ͼ�л���25��Cʱc(H2C2O4)��t�ı仯����ʾ��ͼ�� 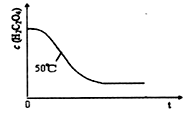
��5����С��ͬѧ��ʵ��1��3�ֱ����������ʵ�飬�������ʵ�����ݣ��ӻ�����ȿ�ʼ��ʱ����
�����������ݺ�ó���������������ͬʱ�����Ը��������Һ��Ũ��ԽС����ɫʱ���Խ�̣�����Ӧ���ʾ�Խ�족�Ľ��ۡ���ͬѧ��Ϊ��С�顰̽����Ӧ��Ũ�ȶ�����Ӱ�족��ʵ�鷽������д������⣬�Ӷ��õ��˴����ʵ����ۣ��������ͬѧ�Ľ���ʵ�鷽�� ______________________��
��6����ʵ����ʹ�õĴ���Ӧѡ��MnSO4����MnCl2��ԭ��������ӷ���ʽ��ʾΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(14��)��ѧ��һֱ�������о����¡���ѹ�¡��˹��̵������·���������ʵ�鱨�����ڳ��¡���ѹ�����������£�N2�ڴ���(��������Fe2O3��TiO2)������ˮ������Ӧ�����ɵ���Ҫ����ΪNH3����һ���о�NH3���������¶ȵĹ�ϵ������ʵ�����ݼ��±�(���ա�N2ѹǿ1.0��105 Pa����Ӧʱ��3 h)��
| T��K | 303 | 313 | 323 | 353 |
| NH3������/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����16�֣�����֪���з�Ӧ���Ȼ�ѧ����ʽΪ��
��1�� C(s) + O2(g) = CO2(g) ��H1 =" -393.5" kJ/mol
��2�� CH3COOH(l) + 2O2(g) = 2CO2(g) + 2H2O(l) ��H2 =" -870.3" kJ/mol
��3�� 2H2(g) + O2(g) = 2H2O(l) ��H3 =" -571.6" kJ/mol
�����:2C(s) + 2H2(g) + O2(g)= CH3COOH(l) ��H4 = ��
����ij�¶��£�����(t��BuNO)2���������CCl4�ܼ��о����Է�����Ӧ��
(t��BuNO)2 ��2(t��BuNO) �����¶��¸÷�Ӧ��CCl4�ܼ��е�ƽ�ⳣ��Ϊ1.4��
��2(t��BuNO) �����¶��¸÷�Ӧ��CCl4�ܼ��е�ƽ�ⳣ��Ϊ1.4��
��1����1L�������м���0.50mol��t-BuNO��2��10minʱ��Ӧ��ƽ�⣬��ʱ��t-BuNO��2��ƽ��ת����Ϊ60%�����跴Ӧ��������Һ���ʼ��Ϊ1L������Ӧ��ǰ10min�ڵ�ƽ������Ϊ�ͣ�t-BuNO��= ����ʽ����������Ӧ��ƽ�ⳣ��K =������ �� ��
��2���йط�Ӧ��(t��BuNO)2 2(t��BuNO) ��������ȷ���ǣ� ��
2(t��BuNO) ��������ȷ���ǣ� ��
A��ѹǿԽ��Ӧ���ת����Խ�� B���¶����ߣ���ƽ��һ�������ƶ�
C���ܼ���ͬ��ƽ�ⳣ��Kֵ��ͬ
��3��ͨ����ɫ�����õ�40��ʱ(t��BuNO)2��(t��BuNO)Ũ����ʱ��ı仯��ϵ�ļ����������±���ʾ������ͬһͼ�л��(t��BuNO)2�ͣ�t��BuNO��Ũ����ʱ��ı仯���ߡ�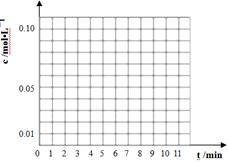
| ʱ�䣨min�� | 0 | 1 | 3 | 5 | 7 | 9 | 11 |
| c(t��BuNO)2 mol/L | 0.05 | 0.03 | 0.01 | 0.005 | 0.003 | 0.002 | 0.002 |
| c(t��BuNO) mol/L | 0 | 0.04 | 0.08 | 0.07 | 0.094 | 0.096 | 0.096 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(16��)���û�ѧ��Ӧԭ���о�NH3�����ʾ�����Ҫ���塣��ش��������⣺
��1����֪����4NH3(g)+3O2(g)===2N2(g)+6H2O(g)  H=-1266.8kJ��mol-1
H=-1266.8kJ��mol-1
��N2(g)+O2(g)===2NO(g)  H=180.5kJ��mol-1
H=180.5kJ��mol-1
д�������´��������Ȼ�ѧ����ʽ ��
��2���������������Թ���ȼ�ϵ�أ����ط�Ӧԭ��Ϊ4NH3+3O2===2N2+6H2O����ԭ�������Һ�� (����ԡ��������ԡ����ԡ�)�������ĵ缫��ӦʽΪ ��
��3���ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���£�
�����ϱ����ݿ�֪�÷�ӦΪ���ȷ�Ӧ�������� ��
�������ϣ�Ϊ������ƽ��ʱH2��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� (����ĸ���)��
a������ѹǿ b��ʹ�ú��ʵĴ���
c�������¶� d����ʱ����������е�NH3
��400oCʱ�����ijʱ�̰��������������������ʵ���Ũ�ȷֱ�Ϊ3mol��L-1��2mol��L-1��1mol��L-1ʱ����ʱ�̸÷�Ӧ��v��(N2) v��(N2)(�>������<����=��)��
��4����25oCʱ����amol��L-1�İ�ˮ��0.1mol��L-1������������ϡ�����Һ��c(NH4+)=c(Cl-)ʱ���ú�a�Ĵ���ʽ��ʾNH3��H2O�ĵ��볣��Kb= ��
����25mL0.10mol��L-1�������еμӰ�ˮ���������ù���������Ũ�ȴ�С��ϵһ������ȷ���� (����ĸ���)��
a��c(Cl-)>c(H+)>c(NH4+)>c(OH-) b��c(C1-)>c(NH4+)=c(H+)>c(OH-)
c��c(NH4+)>c(OH-)>c(Cl-)>c(H+) d��c(OH-)>c(NH4+)>c(H+)>c(Cl-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ӦaA(g)��bB(g) cC(g)(��H<0)�ڵ��������½��С��ı�������Ӧ�������ڢ����ϵ�и�����Ũ����ʱ��仯��������ͼ��ʾ��
cC(g)(��H<0)�ڵ��������½��С��ı�������Ӧ�������ڢ����ϵ�и�����Ũ����ʱ��仯��������ͼ��ʾ��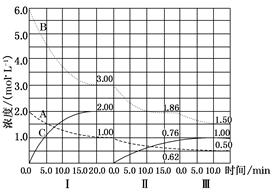
�ش����⣺
(1)B��ƽ��ת���ʦ���(B)������(B)������(B)����С���� ����ֵ�� ��
(2)�ɵ�һ��ƽ��ڶ���ƽ�⣬ƽ���ƶ��ķ����� ����ȡ�Ĵ�ʩ�� ��
(3)�Ƚϵڢ�η�Ӧ�¶�(T2)�͵ڢ�η�Ӧ�¶�(T3)�ĸߵͣ�T2 T3(�>������<����������)���жϵ������� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com