
| A. | Na2S的水解:S2ˉ+2H2O?H2S+2OHˉ | |
| B. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| D. | 向NaClO溶液中通入少量SO2:2ClOˉ+SO2+H2O=SO32ˉ+2HClO |
分析 A.硫离子的水解分步进行,主要以第一步为主;
B.铁与稀硫酸反应生成的是亚铁离子;
C.双氧水具有强氧化性,能够将亚铁离子氧化成铁离子;
D.次氯酸具有强氧化性,能够将亚硫酸根离子氧化成硫酸根离子.
解答 解:A.Na2S的水解分步进行,离子方程式写出第一步即可,正确的水解方程式为:S2ˉ+H2O?HSˉ+OHˉ,故A错误;
B.将铁粉加入稀硫酸中,反应生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+=Fe2++H2↑,故B错误;
C.硫酸亚铁酸性溶液中加入过氧化氢,二者发生氧化还原反应,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,故C正确;
D.向NaClO溶液中通入少量SO2,二者发生氧化还原反应,正确的离子方程式为:3ClOˉ+SO2+H2O=SO42ˉ+2HClO+Cl-,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
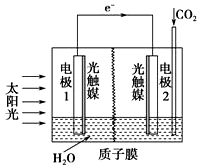
| A. | 该装置将太阳能转化为化学能和电能 | |
| B. | 电极1周围pH减小 | |
| C. | 电极2上发生的反应为CO2+2H++2e-═HCOOH | |
| D. | H+由电极2室经过质子膜流向电极1室 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
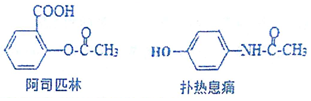
| A. | FeCl3溶液可鉴别阿斯匹林和扑热息痛 | |
| B. | 1mol阿斯匹林最多可消耗2mol的NaOH | |
| C. | 在一定条件,扑热息痛可与HCHO发生缩聚反应 | |
| D. | 二者都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 结论 | |
| A | 室温下测0.1mol•L-1醋酸pH | pH≈3.3 | 醋酸是弱酸 |
| B | 向2mL 0.1mol•L-1NaOH溶液中 i.滴加几滴同浓度的MgSO4溶液 ii.再滴加几滴同浓度FeCl3溶液 | i.产生白色沉淀 ii.产生红褐色沉淀 | 溶解度:Fe(OH)3<Mg(OH)2 |
| C | 常温下,将CO2通入苯酚钠溶液中 | 溶液变浑浊 | 酸性:碳酸>苯酚 |
| D | 将少量溴乙烷与NaOH溶液共热,冷却、HNO3酸化后,滴加AgNO3溶液 | 淡黄色沉淀 | 证明含有溴元素 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 项目 | 空气污染指数(API) | 空气质量级别 | 空气质量描述 |
| 总悬浮颗粒 | 52 | Ⅱ | 良 |
| 二氧化硫 | 7 | I | 优 |
| 二氧化氮 | 24 | I | 优 |
| A. | 用煤和石油产品作燃料 | B. | 汽车排放的尾气 | ||
| C. | 使用含磷洗衣粉 | D. | 焚烧垃圾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com