
【题目】根据金属及其化合物的所学知识回答下列问题:
(1)常温下,在没有氧气存在时,铁与水几乎不反应,但在高温时,铁能与水蒸气反应,写出化学反应方程式:_______________________________。
(2)待(1)中反应完全,反应产物中Fe元素化合价为_________,该产物与盐酸反应的离子方程式为:__________________________________。
(3)将铁粉投入到盛有Cu2+和Fe3+的溶液中,反应完毕时,若烧杯底部有固体剩余,在所涉及的金属元素内溶液中一定不含有的金属离子是________(填离子符号),写出证明溶液中不含有该离子的实验操作:______________________。
(4)某同学将铁、铜混合粉末14.8 g加入到100 mL 4.0 mol/L FeCl3溶液中,充分反应后,烧杯底部还有剩余固体,其质量为2.8 g,则原固体混合物中铜的质量是______g,反应所得溶液中的Fe2+物质的量为_____mol。
【答案】3Fe+H2O(g)![]() Fe3O4+4H2 +2、+3 Fe3O4+8H+=Fe2++2Fe3++4H2O Fe3+ 取少量反应后的溶液于试管,向其中滴加几滴KSCN溶液,若溶液不变红,证明溶液中不含Fe3+ 9.2 0.5
Fe3O4+4H2 +2、+3 Fe3O4+8H+=Fe2++2Fe3++4H2O Fe3+ 取少量反应后的溶液于试管,向其中滴加几滴KSCN溶液,若溶液不变红,证明溶液中不含Fe3+ 9.2 0.5
【解析】
(1)铁与水蒸气反应生成四氧化三铁和氢气,据此解答;
(2)根据四氧化三铁可以用FeO·Fe2O3表示分析解答;
(3)剩余的固体只能是铜或铜与铁的混合物,据此解答;
(4)由于铁比铜活泼,则与FeCl3溶液反应时的先后顺序为:Fe+2Fe3+=3Fe2+、Cu+2Fe3+=Cu2++2Fe2+,原氯化铁溶液中含有氯化铁的物质的量为:n(FeCl3)=4mol/L×0.1L=0.4mol,结合反应的方程式解答。
(1)常温下,在没有氧气存在时,铁与水几乎不反应,但在高温时,铁能与水蒸气反应生成四氧化三铁和氢气,反应的化学反应方程式为3Fe+H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)由于四氧化三铁可以用FeO·Fe2O3表示,所以四氧化三铁中Fe元素化合价为+2、+3价,与盐酸反应的离子方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O;
(3)将铁粉投入到盛有Cu2+和Fe3+的溶液中,铁离子首先氧化单质铁,如果铁过量,则继续和铜离子发生置换反应生成铜,因此反应完毕时,若烧杯底部有固体剩余,则溶液中一定不含有的金属离子是Fe3+,可以用KSCN溶液检验铁离子,即实验操作为取少量反应后的溶液于试管,向其中滴加几滴KSCN溶液,若溶液不变红,证明溶液中不含Fe3+;
(4)铁的还原性强于铜,把铁、铜混合粉末加入氯化铁溶液中,铁先与铁离子反应,氯化铁的物质的量是0.4mol,设0.4mol铁离子完全反应消耗铁、铜的质量分别为x、y,则:
Cu+2Fe3+=Cu2++2Fe2+
64g 2mol
y 0.4mol
解得y=12.8g
Fe+2Fe3+=3Fe2+
56g 2mol
x 0.4mol
解得x=11.2g
溶解的金属质量为:14.8g-2.8g=12g,11.2g<12g<12.8g,则铁完全反应、铜部分反应,因此剩余的金属为Cu,设反应消耗铜的物质的量为amol,反应的铁的物质的量为bmol,则64a+56b=12g、2a+2b=0.4mol,解得a=b=0.1,则原来混合物中含有的铜的质量为:0.1mol×64g/mol+2.8g=9.2g;根据反应方程式可知,反应后溶液中n(Fe2+)=2n(Cu)+3n(Fe)=2×0.1mol+3×0.10mol=0.5mol。


科目:高中化学 来源: 题型:
【题目】现有一瓶甲和乙的混合物,已知甲和乙的某些性质如下表所示:
物质 | 熔点/℃ | 沸点/℃ | 密度/(g·cm-3) | 水中的溶解性 |
甲 | -98 | 57.5 | 0.93 | 可溶 |
乙 | -84 | 97 | 0.90 | 可溶 |
据此,将甲和乙相互分离的方法是( )
A.蒸馏法B.升华法C.萃取法D.过滤法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是( )
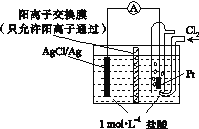
A. 正极反应为AgCl+e-===Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为 0.20mol·L-1的 MgCl2 和 CaCl2 混合溶液中逐滴加入 Na3PO4,先生成沉淀________(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度c________。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
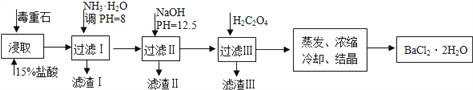
已知: Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
①毒重石用盐酸浸取前需充分研磨,目的是________。
②加入NH3·H2O调节pH=8 可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于说法正确的是
A. HCl和NaOH反应的中和热为57.3kJ/mol,H2SO4和Ba(OH)2反应的中和热也为57.3kJ/mol
B. 已知C2H5OH(l)的燃烧热是1366.8kUmol,则C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)反应的△H=-1366.8kJ/mol
C. 一定温度和压强下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放出热量19.3kJ.则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJ/mol
2NH3(g) △H=-38.6 kJ/mol
D. 一定条件下2SO2(g)+O2(g)![]() 2SO3(g)△H1 2SO2(g)+O2(g)
2SO3(g)△H1 2SO2(g)+O2(g)![]() 2SO3(l)△H2则△H1>△H2
2SO3(l)△H2则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是

A. 装置①中,盐桥(含有琼胶的KCl饱和溶液)中的K+移向ZnSO4溶液
B. 装置②工作一段时间后,a极附近溶液的pH减小
C. 可以用装置③在铁上镀铜,d极为铜
D. 装置④中发生铁的吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、N、Na、Al、Ti等元素在能源、材料等领域应用广泛。回答下列问题:
(一)氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示,为长方体。
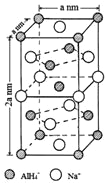
(1)基态Ti原子的价电子排布图为_________,L能层中电子云的形状有_______种。
(2)AlCl3在178℃时升华,属于__________晶体,其蒸气的相对分子质量约为267,蒸气分子的结构式为___________(标明配位键),其中Al的轨道杂化方式为____________。
(3)写出与AlH4-空间构型相同的一种分子和一种离子_________(填化学式)。
(4)NaAlH4晶体中,与AlH4-紧邻且等距的Na+有__________个;NaAlH4晶体的密度为_____________g·cm-3(用含a的代数式表示)。
(二)叠氮化钠和氢叠氮酸(HN3)已一步步进入我们的生活,如汽车安全气囊等。
(1)写出与N3-属于等电子体的一种分子__________(填分子式)。
(2)氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。下列叙述错误的是___(填标号)
A.上述生成HN3的化学方程式为:N2H4+HNO2= HN3+2 H2O
B.NaN3的晶格能大于KN3的晶格能
C.氢叠氮酸(HN3)和水能形成分子间氢键
D.HN3和N2H4都是由极性键和非极性键构成的非极性分子。
E.HN3分子中四个原子可能在一条直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水质量是关系人类健康的重要问题。
(1)在我国,一些贫困山区的农民至今还饮用井水,但暴雨过后井水混浊,无法饮用。为了能让暴雨过后井水尽快变的澄清,你会建议他们最好向井水中投入下列中的___(填序号)。
A.NaCl B.Na2CO3 C.Kal(SO4)2·12H2O D.CuSO4
(2)氯气是最早用于饮用水消毒的物质,其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的离子方程式为:____________________________
(3)写出工业上制取漂白粉的化学方程式:__________________
(4)臭氧,也称作超氧,可以替代氯气给自来水消毒,即提高了消毒效率且安全无副作用,臭氧的分子式为O3,该物质和次氯酸均可以做漂白剂,二者的漂白原理是:_______________。
(5)某化学活动小组设计实验(装置如图)验证氯、溴、碘及其化合物的有关物质。在硬质玻璃管中的A、B、C三处依次放置湿润的蓝色石蕊试纸、浸有NaBr溶液的棉球、浸有淀粉-KI溶液的棉球(如图所示),由左端通入足量氯气,回答下列问题:
![]()
①观察到的现象
A:__________________;B:__________________;C:__________________
②由上述现象得出的结论氧化性:Cl2 > Br2 > I2,你认为正确吗,为什么? ______________;___________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.92 g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到672 mL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A. 336 mL B. 504 mL
C. 224 mL D. 168 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com