
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
分析 (1)根据硫化亚铁的溶度积常数和亚铁离子浓度计算硫离子浓度,再根据氢硫酸的电离平衡常数计算氢离子浓度,最后利用pH计算公式计算溶液的pH;
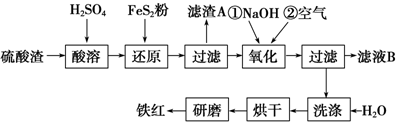
(2)硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,稀硫酸溶解主要除去不与酸反应的SiO2,加入FeS2将溶液中的Fe3+还原为Fe2+,再加氢氧化钠和空气,调节溶液的pH的范围是3.2~3.8主要是使三价铁沉淀,而二价镁,三价铝都不沉淀,最后洗涤、烘干、研磨使氢氧化铁分解生成氧化铁,从而得到铁红;
①氧化铁属于碱性氧化物,与酸反应生成盐和水;Fe2O3、Al2O3、MgO都和硫酸反应,二氧化硅不和酸反应;
②根据得失电子守恒和原子守恒来配平,FeS2中S元素的化合价从-1价升高到+6价,2个S原子转移14个电子,Fe3+转移1个电子,则二者的计量数之比为1:14,根据S守恒可知SO42-前面的化学计量数为2,根据氧守恒可知H20前面化学计量数为8,根据H守恒可知H+前化学计量数为16;
③NaOH与Fe2+反应生成的氢氧化亚铁易被氧化;
④根据几种离子沉淀的pH分析;
⑤因加入的是氢氧化钠来调节PH,所以滤液B中应是未沉淀离子的硫酸盐和硫酸钠.
解答 解:(1)溶液中c(S2-)=$\frac{Ksp}{c(Fe{\;}^{2+})}$=$\frac{8.1×10{\;}^{-17}}{1}$mol/L=8.1×10-17mol/L,c2(H+)•c(S2-)=1.0×10-22,则c(H+)=$\sqrt{\frac{1×10{\;}^{-22}}{8.1×10{\;}^{-17}}}$mol/L=1.11×10-3mol/L,pH=-lg1.11×10-3=3;
故选B;
(2)硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,稀硫酸溶解主要除去不与酸反应的SiO2,加入FeS2将溶液中的Fe3+还原为Fe2+,再加氢氧化钠和空气,调节溶液的pH的范围是3.2~3.8主要是使三价铁沉淀,而二价镁,三价铝都不沉淀,最后洗涤、烘干、研磨使氢氧化铁分解生成氧化铁,从而得到铁红;
①氧化铁与硫酸反应生成硫酸铁和水,方程式为:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;因二氧化硅不与硫酸反应,故“滤渣A”主要成份的化学式为SiO2.
故答案为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;SiO2;
②FeS2中S元素的化合价从-1价升高到+6价,2个S原子转移14个电子,Fe3+转移1个电子,则二者的计量数之比为1:14,根据S守恒可知SO42-前面的化学计量数为2,根据氧守恒可知H20前面化学计量数为8,根据H守恒可知H+前化学计量数为16,则反应的离子方程式为:1FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+,
故答案为:14;8H2O;16H+;15;2;16H+;
③Fe2+与OH-反应生成4Fe(OH)2,Fe(OH)2不稳定易被氧气氧化为Fe(OH)3,用化合价升价法配平方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓,
故答案为:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓;
④根据几种离子沉淀的pH,如果pH过大,Al3+、Mg2+形成沉淀,使制得的铁红不纯;
故答案为:Al3+、Mg2+形成沉淀,使制得的铁红不纯;
⑤未沉淀的离子为Na+、Mg2+、Al3+,故滤液B可以回收的物质有:Na2SO4、Al2(SO4)3、MgSO4,
故选:ABD.
点评 本题考查了物质制备方案的设计及化学实验基本操作方法的综合应用,题目难度中等,明确制备流程及化学实验基本操作方法为解答关键,试题充分考查了学生的分析、理解能力及化学实验能力.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
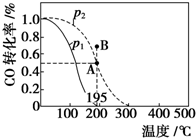 在20L的密闭容器中按物质的量之比为1:2充入CO和H2,发生:CO(g)+2H2(g)?CH3OH(g)△H.测得CO的转化率随温度及不同压强下的变化如图所示,p2和195℃时n(H2)随时间的变化结果如表所示.下列说法正确的是( )
在20L的密闭容器中按物质的量之比为1:2充入CO和H2,发生:CO(g)+2H2(g)?CH3OH(g)△H.测得CO的转化率随温度及不同压强下的变化如图所示,p2和195℃时n(H2)随时间的变化结果如表所示.下列说法正确的是( ) | t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
| A. | p1>p2,△H<0 | |
| B. | 在p2及195℃时,反应前3 min的平均速率v(CH3OH)=0.8 mol•L-1•min-1 | |
| C. | 在p2及195℃时,该反应的平衡常数为25 | |
| D. | 在B点时,v正>v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
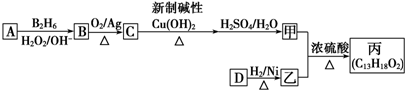
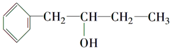 的同系物.
的同系物. .
. ,该反应的类型是取代反应.
,该反应的类型是取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.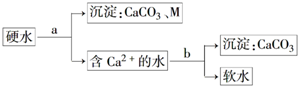
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol甲基(-CH3)中含有7NA个电子 | |
| B. | 1L 0.5mol•L-1的(NH4)2SO4溶液中含有NA个NH4+ | |
| C. | 在铜与硫的反应中,1mol铜失去的电子数为NA | |
| D. | 36g C5H12分子中含有8NA个共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com