(2012?石家庄一模)目前高铁酸钠(Na
2FeO
4)被广泛应用于水处理,具有高效、无毒的优点.
(1)将Fe(OH)
3与NaClO溶液混合,可制得Na
2FeO
4,完成并配平下列离子方程式
2
2
Fe(OH)
3+
3
3
ClO
-+
4OH-
4OH-
=
2
2
FeO
42-+
3
3
Cl
-+
5H2O
5H2O
(2)某地海水样品经Na
2FeO
4处理后,所含离子及其浓度如下表所示(H
+和0H
-未列出):
| 离子 |
SO42- |
Mg2+ |
Fe3+ |
Na+ |
Cl- |
| 浓度(mol/L) |
a |
0.05 |
0.10 |
0.50 |
0.58 |
常温下,取一定量经Na
2FeO
4处理过的海水为原料制备精制食盐水和MgCl
2?7H
20,过程如下:
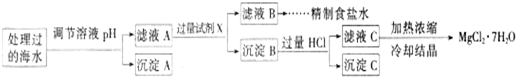
注:离子的浓度小于1.0×10
-5mol/L,可认为该离子不存在;K
sp[Fe(OH)
3]=1.0×10
-38 K
sp[Mg(OH)
2]=5.0×10
-12;操作过程中溶液体积变化忽略不计.
①表格中的a
>
>
0.16 (填“<”、“>”或“=”).
②沉淀A的组成为
Fe(OH)3
Fe(OH)3
(填化学式)
③加入的过量试剂X为
Ba(OH)2
Ba(OH)2
(填化学式)
④加入过量HCl的作用为
使Mg(OH)2全部溶解转化为MgCl2;在加热浓缩滤液C时抑制Mg2+水解
使Mg(OH)2全部溶解转化为MgCl2;在加热浓缩滤液C时抑制Mg2+水解
.



