
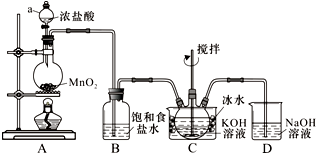
 实验室用图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.
实验室用图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.分析 根据实验装置图可知,A装置中用二氧化锰与浓盐酸加热制得氯气,氯气中有挥发出的来的氯化氢,所以B装置中饱和食盐水是除去氯气中的氯化氢,装置C中用氯气与氢氧化钾溶液应制得次氯酸钾,为防止在较高温度下生成KClO3,C装置中用冰水浴,反应的尾气氯气用D装置中氢氧化钠吸收,
(1)根据装置图可知仪器名称;Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3,据此判断冰水浴的原因;
(2)氯气中有氯化氢需要除去,氯气有毒,需要进行尾气吸收;
(3)足量KClO中依次加入KOH溶液、Fe(NO3)3溶液,发生氧化还原反应生成K2FeO4、KCl和水等,据此书写该反应的离子方程式;
(4)K2FeO4易溶于水、微溶于浓KOH溶液,所以提纯K2FeO4粗产品时可以①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中,②过滤,③将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,④搅拌、静置、过滤,用乙醇洗涤2~3次,⑤在真空干燥箱中干燥,据此答题;
(5)根据反应Cr(OH)4-+FeO42-═Fe(OH)3↓+CrO42-+OH-和Cr2O72-+6Fe2++14H+═6Fe3++2Cr3++7H2O,可得关系式2FeO42-~Cr2O72-~6Fe2+,利用(NH4)2Fe(SO4)2的物质的量可计算得高铁酸钾的质量,进而确定K2FeO4样品的纯度;
解答 解:根据实验装置图可知,A装置中用二氧化锰与浓盐酸加热制得氯气,氯气中有挥发出的来的氯化氢,所以B装置中饱和食盐水是除去氯气中的氯化氢,装置C中用氯气与氢氧化钾溶液应制得次氯酸钾,为防止在较高温度下生成KClO3,C装置中用冰水浴,反应的尾气氯气用D装置中氢氧化钠吸收,
(1)根据装置图可知仪器a的名称是分液漏斗,Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3,所以冰水浴的目的是防止Cl2与KOH反应生成KClO3,
故答案为:分液漏斗;防止Cl2与KOH反应生成KClO3;
(2)氯气中有氯化氢需要除去,氯气有毒,需要进行尾气吸收,所以装置B吸收的气体是HCl,装置D的作用是吸收Cl2,防止污染空气,
故答案为:HCl;吸收Cl2,防止污染空气;
(3)足量KClO中依次加入KOH溶液、Fe(NO3)3溶液,发生氧化还原反应生成K2FeO4、KCl和水等,反应的离子方程式为3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O,
故答案为:3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O;
(4)K2FeO4易溶于水、微溶于浓KOH溶液,所以提纯K2FeO4粗产品时可以①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中,②过滤,③将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,④搅拌、静置、过滤,用乙醇洗涤2~3次,⑤在真空干燥箱中干燥,
故答案为:过滤;将滤液置于冰水浴中,向滤液中加入饱和KOH溶液;
(5)根据反应Cr(OH)4-+FeO42-═Fe(OH)3↓+CrO42-+OH-和Cr2O72-+6Fe2++14H+═6Fe3++2Cr3++7H2O,可得关系式2FeO42-~Cr2O72-~6Fe2+,根据题意可知,(NH4)2Fe(SO4)2的物质的量为0.03L×0.01000 mol/L=0.0003mol,所以高铁酸钾的质量为$0.0003mol×\frac{1}{3}×198g/mol$×$\frac{250mL}{25mL}$=0.198g,所以K2FeO4样品的纯度为$\frac{0.198g}{0.2100g}$×100%=94.3%,
故答案为:94.3%;
点评 本题考查实验制备方案、氧化还原反应的离子方程式的书写、物质的分离提纯、对条件与操作的分析评价、纯度的计算等,是对学生综合能力的考查,注意题目信息的迁移运用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯气泄漏时,用湿毛巾捂住嘴鼻往高处跑 | |
| B. | NH3泄漏时,向空中喷洒水雾 | |
| C. | 钾、钠着火时,用大量水灭火 | |
| D. | 湖水被酸雨污染,向湖水中喷洒石灰石粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 | |
| B. | 常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成 | |
| C. | 金属钠放入硫酸铜溶液中可以置换出金属铜 | |
| D. | 将铜丝插入浓硫酸加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色将表面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONa溶液中含有少量的CH3COOH | |
| B. | 醋酸钠溶液的pH大于7 | |
| C. | 醋酸钠溶液中滴入酚酞显红色,加热后颜色变深 | |
| D. | 醋酸钠溶液与浓H2SO4微热,可逸出醋酸蒸气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有机充电电池具有不含重金属,受资源限制少等优点而备受瞩目.某PYT-锂电池总反应如图,下列叙述不正确的是( )
有机充电电池具有不含重金属,受资源限制少等优点而备受瞩目.某PYT-锂电池总反应如图,下列叙述不正确的是( )| A. | PYT分子式为C16H6O4 | B. | 不能采用水溶液作为电解质溶液 | ||
| C. | 充电时,负极反应为Li-e-=Li+ | D. | 放电时,Li+向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化 | |
| B. | 铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中一定不含Fe2O3 | |
| C. | 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 | |
| D. | 检验Cu2+和Fe3+离子,采用径向纸层析法,待离子在滤纸上展开后,用浓氨水熏,可以检验出Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)═c(HCO3-)+c(CO32-)+c(H2CO3) | |
| B. | c (Na+)+c (H+)═c (HCO3-)+c (CO32-)+c (OH-) | |
| C. | HCO3- 的电离程度大于HCO3-的水解程度 | |
| D. | c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com