
 在$\frac{C{u}_{2}O}{ZnO}$做催化剂的条件下,将1molCO(g)和2molH2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH(g)的物质的量(n)与时间(t)及温度的关系如图所示:
在$\frac{C{u}_{2}O}{ZnO}$做催化剂的条件下,将1molCO(g)和2molH2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH(g)的物质的量(n)与时间(t)及温度的关系如图所示:分析 ①在300℃时,达平衡时CH3OH的平衡物质的量为0.8mol,结合方程式CO(g)+2H2(g)=CH3OH计算各物质的平衡浓度,可计算平衡常数;
②在500℃时,达平衡时CH3OH的平衡物质的量为0.5mol,可计算消耗氢气的物质的量,进而计算反应速率;
③缩小容器的体积相当于加压,然后根据压强对浓度、速率和化学平衡的影响来解答.
解答 解:①在300℃时,达平衡时CH3OH的平衡物质的量为0.8mol,
CO(g)+2H2(g)=CH3OH
起始(mol/L) 0.5 1 0
转化(mol/L) 0.4 0.8 0.4
平衡(mol/L) 0.1 0.2 0.4
K=$\frac{0.4}{0.1×0.{2}^{2}}$=100,
故答案为:100;
②在500℃,反应2S达到平衡,密闭的容器容积为2L,生成CH3OH的物质的量为0.5mol,v(CH3OH)=$\frac{\frac{0.5mol}{2L}}{2s}$=0.125mol•L-1•s-1,根据速率之比等于系数比,则氢气的平均反应速率v(H2)=2v(CH3OH)=0.25mol•L-1•s-1.故答案为:0.25mol•L-1•S-1;
③其他条件不变时,将处于Z点的体系体积压缩到原来的一半,容器的体积减小,则压强增大,正逆反应速率都增大,平衡向正向移动,甲醇的物质的量n(CH3OH)增多,氢气的物质的量n(H2)减小,但由于体积减小的程度大,故平衡时氢气的浓度反而增大(符合勒夏特列原理),重新平衡时$\frac{n(CO)}{n(C{H}_{3}OH)}$减小;
故答案为:bc.
点评 本题考查化学平衡的影响因素和化学平衡的标志等问题,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意外界条件对化学平衡移动的影响以及平衡状态的判断角度.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 滴加稀盐酸 | 有气泡产生 | 原溶液中有CO32- |
| B | 滴加盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 原溶液中有Ag+或SO42- |
| C | 用洁净铂丝蘸取溶液进行灼烧 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是用来描述物质所含微粒数目多少的基本物理量 | |
| B. | 1 mol氯约含有 6.02×1023个微粒 | |
| C. | 水的摩尔质量是它的相对分子质量 | |
| D. | 1 cm3铁所含有的铁原子数是$\frac{ρ•{N}_{A}}{56}$( ρ是铁的密度,单位为 g/cm3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
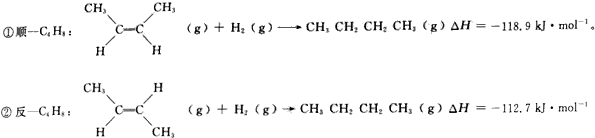


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
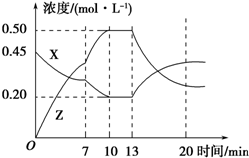
| A. | 用X表示0~10 min内该反应的平均速率为v(X)=0.045 mol•L-1•min-1 | |
| B. | 根据上图可求得化学方程式中a:b=1:3 | |
| C. | 推测在第7 min时曲线变化的原因可能是升温 | |
| D. | 推测在第13 min时曲线变化的原因可能是降温 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
| A. | 反应在前 5min 的平均速率为 v (SO2)=0.08mol•L-1•min-1 | |
| B. | 保持温度不变,向平衡后的容器中再充入 1molSO2和 0.5molO2时,v (正)>v (逆) | |
| C. | 该温度,反应的平衡常数为 11.25L•mol-1 | |
| D. | 相同温度下,起始时向容器中充入 1.5mol SO3,达平衡时 SO3的转化率为 40% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | CH3COOH | H2CO3 | AgCl | Ag2CrO4 |
| Ka或Ksp | Ka=1.8×10-5 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ksp=1.8×10-10 | Ksp=2.0×10-12 |
| A. | 常温下,相同浓度①CH3COONH4 ②NH4HCO3 ③(NH4)2CO3溶液中,c(NH4+)由大到小的顺序是:①>②>③ | |
| B. | 向饱和氯水中滴加NaOH 溶液至溶液刚好为中性时,c(Na+)=2c(ClO-)+c(HClO) | |
| C. | AgCl 易溶于氨水难溶于水,所以AgCl 在氨水中的Ksp 大于水中的 Ksp | |
| D. | 向浓度均为1×10-3mol•L-1的KCl 和K2CrO4混合液中滴加1×10-3mol•L-1 的AgNO3溶液,CrO42-先形成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下分别测等体积、等浓度的醋酸和氨水pH,发现二者的pH 之和为14,说明常温下醋酸和氨水的电离平衡常数相等 | |
| B. | 将CH3COONa溶液从25℃升温至 40℃,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$增大 | |
| C. | 向硝酸中加入氨水至中性,溶液中$\frac{{c(N{H_4}^+)}}{{c(N{O_3}^-)}}$<1 | |
| D. | 向AgCl、AgBr 的饱和溶液中加入少量 AgNO3,溶液中$\frac{c(C{l}^{-})}{c(B{r}^{-})}$增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com