
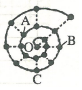
 小明在研究元素时发现,可以将前18号元素排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
小明在研究元素时发现,可以将前18号元素排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 虚线相连的元素处于同一族,A元素位于元素周期表ⅥA族 | |
| B. | 离O点越远的元素原子半径一定越大 | |
| C. | B、C最高价氧化物的水化物可以相互反应 | |
| D. | B元素是图中金属性最强的元素 |
分析 O点代表氢元素,按照原子序数由小到大由里往外延伸,由图可知,O、B连线的三元素为第ⅠA族,A为O元素,B为Na元素,C为Al元素,根据元素的种类可知虚线相连的元素处于同一族,结合对应元素的性质解答该题.
解答 解:由上述分析可知,A为O,B为Na,C为Al,
A.A元素为O,位于元素周期表ⅥA族,故A正确;
B.离O点越远的元素原子的核电荷数增大,若同周期时原子序数大的原子半径小,故B错误;
C.B、C最高价氧化物的水化物分别为NaOH、氢氧化铝,可以相互反应生成偏铝酸钠和水,故C正确;
D.Na、Al为金属元素,同周期从左向右金属性减弱,则Na的金属性强,故D正确;
故选B.
点评 本题考查位置、结构与性质,为高频考点,把握元素在周期表的位置、元素周期律为解答的关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Zn与稀硫酸反应制取H2时,加入少量硫酸铜 | |
| B. | Al和稀硫酸反应制取H2时,将稀硫酸换成浓硫酸 | |
| C. | 石灰石与稀盐酸反应生成CO2时,将石灰石粉碎 | |
| D. | 用KClO3固体分解制取O2时,固体中添加少量MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
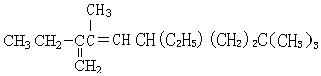 3,8,8-三甲基-2,5-二乙基-1,3-壬二烯
3,8,8-三甲基-2,5-二乙基-1,3-壬二烯 6-甲基-6-乙基-2-辛炔.
6-甲基-6-乙基-2-辛炔.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 | 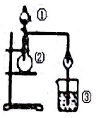 |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 碱石灰 | Al2(SO4)3溶液 | Al(OH)3具有两性 | |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| D | 稀盐酸 | Na2C03 | Na2Si03 | 非金属性:C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
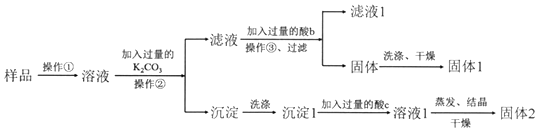
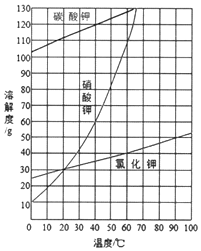
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com