
【题目】用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是( )

A. 电子通过盐桥从乙池流向甲池
B. 铜导线替换盐桥,铜片上发生的反应是:Cu2++2e-=Cu
C. 开始时,银片上发生的反应是Ag-e-=Ag+
D. 将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同
科目:高中化学 来源: 题型:
【题目】对于密闭容器中进行的反应N2+O2![]() 2NO,下列条件能加快其反应速率的是( )
2NO,下列条件能加快其反应速率的是( )
A.增大体积使压强减小
B.体积不变,充入N2使压强增大
C.体积不变,充入He使压强增大
D.压强不变,充入气体Ne
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
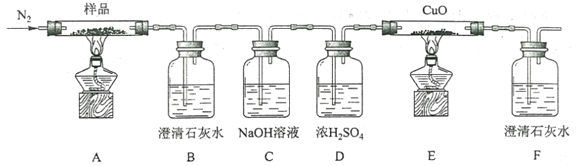
①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁、铝的混合物进行如下实验:

(1)操作X的名称是________。
(2)气体A是________(填化学式)。
(3)A与Cl2混合光照可能发生爆炸,A在该反应中作________(填“氧化剂”或“还原剂”)。
(4)溶液B中的阴离子除OH-外还有________(填离子符号,下同),溶液D中存在的金属离子为________。
(5)加入足量NaOH溶液时发生反应的离子方程式为___________;加入稀盐酸发生反应的离子方程式为_________。
(6)向溶液D中加入NaOH溶液,观察到产生的白色絮状沉淀迅速变为灰绿色,最终变为红褐色,请写出沉淀转化的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小王要制备纯净的二氧化碳气体,可供选用的仪器如图所示。可供选用的药品如下:①石灰石②澄清石灰水③稀硫酸④浓硫酸⑤盐酸溶液⑥烧碱溶液⑦蒸馏水。下列装置连接顺序及组合最恰当的是( )

A. A(①⑤)、B(④)、C(⑦)、DB. A(①③)、B(④)、C(⑦)、D
C. A(①⑤)、B(⑦)、C(④)、DD. A(①⑤)、B(⑥)、C(④)、D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
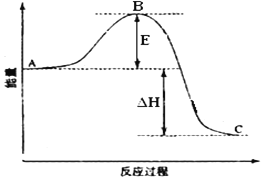
请回答下列问题:
(1)此反应为:_____________(填“吸热反应”或“放热反应”)。
(2)图中E的大小对该反应的反应热________(填“有”或“无”)影响。该反应通常用V2O5作催化剂加快反应速率,加V2O5会使图中B点_________ (填“升高”还是“降低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现以淀粉或乙烯为主要原料都可以合成乙酸乙酯,其合成路线如图所示。

(已知:2CH3CHO+O2![]() 2CH3COOH)
2CH3COOH)
(1)A中含有的官能团名称是______________;其中③的反应类型是______________;
⑥的反应类型是______________;
(2)写乙烯的电子式:_________________乙烯的结构简式:____________;
(3)写出下列反应的化学方程式:①__________________;⑤______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 为四种常见元素,其中 X、Y、Z 为短周期元素。ZX4分子是由粗Z提纯Z的中间产物,X的最高价氧化物对应的水化物为无机酸中的最强酸,Y的离子在同周期中离子半径最小,其氧化物有两性且可用于制造一种极有前途的高温材料,Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料,W原子的最外层电子数小于4且W的常见化合价有+3、+2,WX3 的稀溶液呈黄色,回答下列问题:
(1)X在元素周期表的位置________________,其简单阴离子的结构示意图为____________________,用电子式表示X的氢化物的形成过程______________________________。
(2)Z的氧化物在通讯领域用来作_______________。锗与Z是同一主族元素,它可用来制造半导体晶体管。研究表明:有机锗具有明显的抗肿瘤活性,锗不与 NaOH溶液反应但在有 H2O2 存在时可与NaOH溶液反应生成锗酸盐,反应的化学方程式为:_______________________________
(3)W(OH)2 在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为:____________________________________,若灼烧W(OH)2 固体得到___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。已知在25℃、101kPa下,8gN2H4(g)完全燃烧生成氮气和液态水时,放出133.5 kJ热量。则下列热化学方程中正确的是( )
A. N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
B. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJ·mol-1
C. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=+534kJ·mol-1
D. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com