
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
 .
. .
. 分析 根据元素周期表结构可知,①为H元素、②为O元素、③为Na元素、④为Si元素、⑤为S元素、⑥为Cl元素,
(1)②为O元素,氧离子的核电荷数为8,核外电子总数为10,最外层达到8电子稳定结构,据此画出离子结构示意图;
(2)②、③、⑤分别为O、Na、S元素,离子的电子层越多,离子半径越大,电子层相同时,离子的核电荷数越大,离子半径越小;
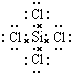
(3)元素④和⑥分别为硅和Cl,二者形成的化合物四氯化硅,四氯化硅为共价化合物,Si、Cl原子最外层都满足8电子稳定结构,据此写出四氯化硅的电子式.
解答 解:根据各元素在周期表中的相对位置可知,①为H元素、②为O元素、③为Na元素、④为Si元素、⑤为S元素、⑥为Cl元素,
(1)②为O元素,氧离子的核电荷数为8,核外电子总数为10,其离子结构示意图为: ,
,
故答案为: ;
;
(2)②、③、⑤分别为O、Na、S元素,离子的电子层越多,离子半径越大,则S2-的离子半径最大,电子层相同时,离子的核电荷数越大,离子半径越小,则离子半径:O2->Na+,所以离子半径大小为:S2->O2->Na+,
故答案为:S2->O2->Na+;
(3)元素④和⑥形成的化合物四氯化硅,四氯化硅为共价化合物,Si、Cl原子最外层都满足8电子稳定结构,其电子式为 ,
,
故答案为: .
.
点评 本题考查了位置、结构与性质的综合应用,题目难度不大,根据元素周期表结构正确推断元素为解答结构,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 纸层析实验中,须将滤纸上的试样点浸入展开剂中 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度不一定要比水大 | |
| C. | 从碘水中提取单质碘时,不能用无水乙醇代替CCl4 | |
| D. | 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | TNT | B. | 白磷的CS2溶液 | C. | 黑火药和甘油 | D. | KMnO4和H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol Fe和0.1mol Zn被氧化,共转移电子0.2mol | |
| B. | 标准状况下,22.4L N2和N2O4的混合物,含N原子2mol | |
| C. | 16g O2和O3的混合物,含电子8mol | |
| D. | 常温常压下,12g CO和12g N2体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
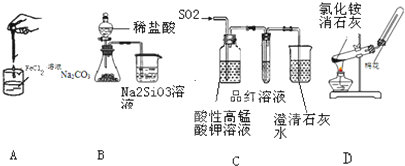
| A. | 制备氢氧化亚铁 | B. | 验证非金属性Cl>C>Si | ||
| C. | 检验二氧化硫中是否混有二氧化碳 | D. | 实验室制取并收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol氢的质量是1 g | B. | 1 mol CO的质量为28 g•mol-1 | ||
| C. | 阿伏加德罗常数等于6.02×1023 | D. | 3.01×1023个SO2分子约是0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

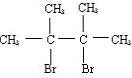
 .
.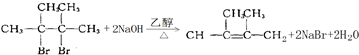 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
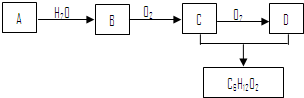
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是烃 | B. | 不能在空气中燃烧 | ||
| C. | 常温下呈固态 | D. | 可能发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com