
下面的表格是元素周期表的一部分,其中的序号对应的是元素.
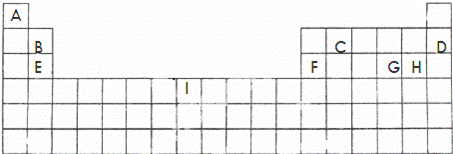
请回答下列问题:
(1)按原子轨道的重叠方式看,元素A、C形成的相对分子质量最小的分子含 键;元素E和H形成的化学键类型为 .
(2)上表中所列举的某元素最外电子层上p电子数比s电子数少1,则该元素的元素符号为
(3)B、D、E、F四种元素的第一电离能由大到小的顺序是(填元素符号) .
(4)元素I的价电子排布式为 .I元素通常情况下能形成两种离子,其中较稳定的是Fe3+,其原因是 .
(5)硒(se)是人体必需的微量元素,与G同一主族,Se原子比G原子多一个电子层.则:Se的原子序数为34,其原子结构示意图为 .
(6)G、H两元素能形成G2H2,它是一种琥珀色液体,是合成硫化染料的重要原料.它的熔点﹣80℃,沸点138℃.常温下,它遇水易反应,产生使品红褪色的气体,且溶液出现浑浊.
①S2Cl2遇水反应产生气体,该气体分子是 (填“极性”或“非极性”)分子.
②写出二氯化硫与水反应的化学方程式 .
考点: 元素周期律和元素周期表的综合应用.
分析: 根据元素周期表知,A、B、C、D、E、F、G、H、I分别是H、Be、C、Ne、Mg、Al、S、Cl、Fe元素,
(1)A是H元素、C是C元素,元素A、C形成的相对分子质量最小的分子是CH4,原子之间形成的共价单键为σ键;E是Mg元素、H是Cl元素,活泼金属和活泼非金属元素之间易形成离子键;
(2)上表中所列举的某元素最外电子层上p电子数比s电子数少1,则最外层p电子为1,该元素属于第IIIA族元素;
(3)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族元素其第一电离能随着原子序数增大而减小;
(4)元素I是Fe元素,其价电子为3d、4s电子,根据构造原理书写该元素的价电子排布式;I元素通常情况下能形成两种离子,其中较稳定的是F 3+,原子轨道中处于全满、全空或半满时最稳定;
(5)G是S元素,硒(se)与G同一主族,Se原子比G原子多一个电子层.则:Se的原子序数=16+18=34,根据原子核外电子排布书写其原子结构示意图;
(6)①G是S元素、H是Cl元素,G、H两元素能形成S2Cl2,它的熔点﹣80℃,沸点138℃.常温下,它遇水易反应,产生使品红褪色的气体,且溶液出现浑浊,说明该反应中生成SO2和S,同时生成HCl,分子中正负电荷重心不重合的为极性分子,否则为非极性分子;
②根据反应物和生成物书写反应方程式.
解答: 解:根据元素周期表知,A、B、C、D、E、F、G、H、I分别是H、Be、C、Ne、Mg、Al、S、Cl、Fe元素,
(1)A是H元素、C是C元素,元素A、C形成的相对分子质量最小的分子是CH4,原子之间形成的共价单键为σ键,所以H原子和C原子之间存在σ键;E是Mg元素、H是Cl元素,活泼金属和活泼非金属元素之间易形成离子键,所以Mg和Cl元素形成的化学键是离子键,
故答案为:σ;离子键;
(2)上表中所列举的某元素最外电子层上p电子数比s电子数少1,则最外层p电子为1,该元素属于第IIIA族元素,为Al元素,故答案为:Al;
(3)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族元素其第一电离能随着原子序数增大而减小,稀有气体最难失电子,所以其第一电离能最大,所以电离能大小顺序是Ne>Be>Mg>Al,故答案为:Ne>Be>Mg>Al;
(4)元素I是Fe元素,其价电子为3d、4s电子,根据构造原理知该元素的价电子排布式为3d64s2;I元素通常情况下能形成两种离子,其中较稳定的是F3+,原子轨道中处于全满、全空或半满时最稳定,Fe3+的价电子层为3d5,半充满较稳定,
故答案为:3d64s2;Fe3+;Fe3+的价电子层为3d5,半充满较稳定;
(5)G是S元素,硒(se)与G同一主族,Se原子比G原子多一个电子层.则:Se的原子序数=16+18=34,根据原子核外电子排布知其原子结构示意图为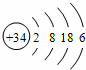 ,故答案为:34;
,故答案为:34;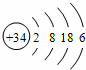 ;
;
(6)①G是S元素、H是Cl元素,G、H两元素能形成S2Cl2,它的熔点﹣80℃,沸点138℃.常温下,它遇水易反应,产生使品红褪色的气体,且溶液出现浑浊,说明该反应中生成SO2和S,同时生成HCl,SO2分子中价层电子对个数是3且含有一个孤电子对,所以为V形结构,正负电荷重心不重合,为极性分子,故答案为:极性;
②根据反应物和生成物知,反应方程式为 2 S2Cl2+2H2O=SO2↑+4HCl+3S↓,故答案为:2 S2Cl2+2H2O=SO2↑+4HCl+3S↓.
点评: 本题考查元素周期表和元素周期律综合应用,综合性较强,涉及分子极性判断、原子核外电子排布、化学键等知识点,侧重考查基本理论、基本概念,熟练掌握物质结构、元素化合物知识,题目难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
天然维生素P(结构简式如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是 ( )。
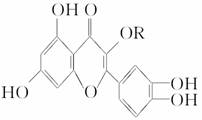
A.可以和溴水反应
B.可用有机溶剂萃取
C.分子中有三个苯环
D.1 mol维生素P可以和4 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为周期表的一部分,有关短周期X、Y、Z、R四种元素叙述正确的是 ( )。
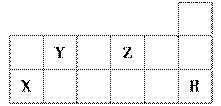
A.热稳定性:Y的气态氢化物<Z的气态氢化物
B.X的最高价氧化物对应水化物的酸性比Y的强
C.X元素的单质能与所有强酸发生反应放出H2
D.R元素的单质化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于杂化轨道的叙述中,不正确的是()
A. 分子中中心原子通过sp2杂化轨道成键时,该分子不一定为平面三角形结构
B. 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子
C. N2分子中N原子没有杂化,分子中有1个σ键、2个π键
D. H2SO4分子中三种原子均以杂化轨道成键
查看答案和解析>>
科目:高中化学 来源: 题型:
SCR法(选择性催化还原技术)是一种以NH3作为还原剂,将烟气中NOx分解成无害的N2和H2O的干法脱硝技术,反应原理为:①6NO+4NH3═5N2+6H2O;②6NO2+8NH3═7N2+12H2O;③NO+NO2+2NH3═2N2+3H2O.下列说法正确的是()
A. 汽车尾气中含有NOx,NOx是引起温室效应的主要气体之一
B. N2中π键与σ键之比为1:2
C. 反应③中每生成标况下的22.4 L N2转移电子数1.5NA
D. NH3的沸点比PH3的沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
用括号中的试剂除去各组物质中的少量杂质正确的是( )
|
| A. | 苯中的甲苯(溴水) | B. | 乙酸乙酯中的乙酸(NaOH溶液) |
|
| C. | 乙醇中的乙酸(NaOH溶液) | D. | 乙醇中的水(新制的CaO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mLzxxk
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com