
分析 根据题目的条件,因取相同质量的四种化合物,溶解于水,配成相同体积的溶液,其物质的量浓度由大到小的顺序是A、B、C、D,故四种物质的式量有如下关系D>C>B>A,又A、B、C、D是四种可溶性离子化合物,所以可得A、B、C、D分别为氢氧化钠、氯化镁、碳酸铵、硝酸银,以此来解答.
解答 解:四种离子化合物均溶于水,Ag+只能与NO3-共存,Mg2+只能与Cl-共存,剩余两种物质分别为NaOH、(NH4)2CO3,其物质的量浓度由大到小的顺序是A、B、C、D,故四种物质的式量有如下关系D>C>B>A,则A、B、C、D分别为NaOH MgCl2 (NH4)2CO3 AgNO3,
故答案为:NaOH; MgCl2;(NH4)2CO3;AgNO3.
点评 本题考查离子的检验及分离,为高频考点,把握离子的共存、物质的量与摩尔质量的关系为解答的关键,侧重分析与应用能力的考查,注意可溶性离子化合物的限制条件,题目难度不大.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:选择题
下列关于化学反应类型的叙述中,正确的是
A.凡是生成盐和水的反应都是中和反应
B.复分解反应一定没有单质参加
C.生成一种单质和一种化合物的反应一定是置换反应
D.分解反应的生成物一定有单质]
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
有一支50mL酸式滴定管其中盛有溶液,液面恰好在10mL刻度处,现把管内溶液全部流下排出,用量筒承接,该溶液的体积应为
A.10mL B.40mL C.大于40mL D.小于40mL
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新生活方式.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p63s23p63d104s1 | B. | 1s22s22p63s23p63d64s2 | ||
| C. | 1s22s22p63s23p63d34s2 | D. | 1s22s22p63s23p63d44s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
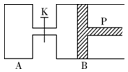 图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入1mol X、1mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达平衡时,VB=0.6a L.回答下列问题:
图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入1mol X、1mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达平衡时,VB=0.6a L.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com