
����Ŀ������˵������ȷ����( )
A. 25��ʱ NH4Cl ��Һ�� KW ���� 100��ʱ NaCl ��Һ�� KW
B. �����£�pH ��Ϊ 5 �Ĵ����������������Һ�У���ˮ�������������Ũ��֮��Ϊ 1��104
C. ������Һ�� pH ������ԵĹ�ϵ���Ƴ� pH��6.8 ����Һһ��������
D. 100��ʱ���� pH��2 �������� pH��12 �� NaOH ��Һ�������ϣ���Һ������
���𰸡�B
��������
A��ˮ�ĵ��������ȷ�Ӧ�������¶����ӻ������������� 25��ʱ NH4Cl ��Һ�� KW С�� 100��ʱ NaCl ��Һ�� KW����A ����
B.�����£�pH��5 �Ĵ�����Һ��ˮ������� c(H+)��10��9 mol/L����������Һ��ˮ������� c(H+)��10��5mol/L������ˮ�������������Ũ��֮��Ϊ 1��104���� B ��ȷ��
C.�¶�δ֪���ܸ�����Һ�� pH �ж���Һ����ԣ��� 100��ʱ������Һ pH��6������¶��� pH��6.8����Һ�ʼ��ԣ��� C ����
D.100��ʱ��ˮ�����ӻ���������1![]() 10��14��pH��2 �������� c(H+)��0.01mol/L��pH��12 �� NaOH ��Һ�� c(OH��)>0.01mol/L�����ߵ������ϣ�����ʣ�࣬�����Һ�ʼ��ԣ��� D ����
10��14��pH��2 �������� c(H+)��0.01mol/L��pH��12 �� NaOH ��Һ�� c(OH��)>0.01mol/L�����ߵ������ϣ�����ʣ�࣬�����Һ�ʼ��ԣ��� D ����
��ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������ͼ��ʾװ��̽��������ķ�Ӧԭ����
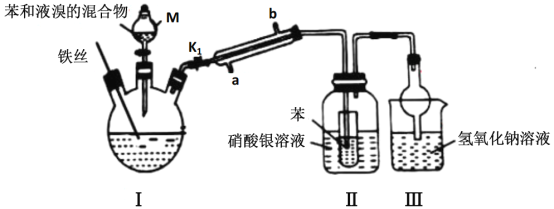
��ش��������⣺
(1) ����M������Ϊ__________��
(2) װ�â�����˿���������⣬���ɿ��Ʒ�Ӧ�Ľ��У�ʹ��Ӧֹͣ�IJ�����__________��
(3)װ�â��������屽�Ļ�ѧ����ʽΪ______________________________��
(4)�����ܵĽ�ˮ��Ϊ________��(����a������b��������ͬ����������_____________��
(5)����֤����Һ�巢������ȡ����Ӧ��������______________��
(6)װ�â��У�����ȥװ�б���С�Թܣ�������ֱ�Ӳ�����������Һ����ʵ��Ŀ�Ĵ�ɻ����ʲôӰ��__________________________
(7)װ��III�е����ӷ�Ӧ����ʽΪ_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ͼ���ʾ�����������Ԫ�أ������P�����ã�����a��b��d��e��f����С���ӣ�A��B��E������ͬ���������ӣ����ͼ�ش��������⡣
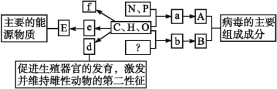
(1)����a��ʾ_______������ԭ��ϸ���й���______�֡�
(2)��E�Ƕ���ϸ�������еĴ������ʣ���E��_______,������������Ҫ�ֲ���______ϸ����
(3)����d��_____������f��_______�����ڶ�ֲ��ϸ���о��ɺ��У��������ں����������ռ���С��������Ϊ���ڴ�����Դ�����ʡ�
(4)����b��������______,ͼ�еġ�?����ָ______Ԫ�ء���ij��B������n��b(ƽ����Է�������Ϊm)�γɵ����������,���B���ӵ���Է���������ԼΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���10mL0.1mol��L��1NaOH��Һ�м���0.1mol��L��1��һԪ��HA����ҺpH�ı仯������ͼ��ʾ������˵����ȷ����
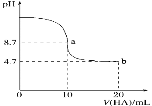
A.a����ʾ��Һ��c(Na��)>c(A��)>c(H��)>c(HA)
B.pH��7ʱ������HA�����<10mL
C.pH��7ʱ��c(Na��)��c(A��)��c(HA)
D.b����ʾ��Һ��c(A��)>c(HA)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڹ�ũҵ��ҽѧ������й㷺��Ӧ�á������ǹ�ҵ���Ʊ��������ص����ַ������ش��������⣺
I.ֱ�ӷ�
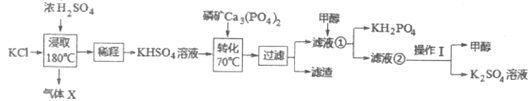
(1)����XΪ___________(�ѧʽ)��
(2)����ȡ�����裬Ũ��������KCl�ܷ�����ѧ��Ӧ��ԭ����___________________��
(3)��ת�������跢����Ӧ�����ӷ�Ӧ����ʽ_______________(��֪��Ca3(PO4)2������ˮ)��
(4)��Һ���м���״���������__________________________��
(5)������I����___________________________________��
II.�кͷ�Ӧ��
(6)����������Һ��ߴ��������ڷ�Ӧ���з����кͷ�Ӧ�Ʊ��������ء�д���˷�Ӧ�����ӷ�Ӧ����ʽ_______________________________������ͼ�ж��Ʊ���������(��80%)�����pH��Χ______________________��
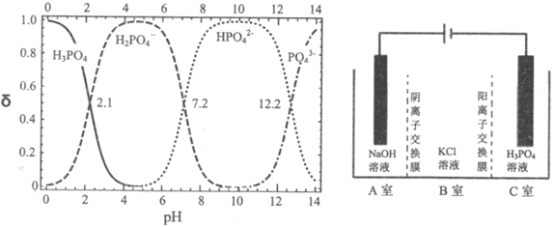
��.��ⷨ��ȡKH2PO4��ԭ������ͼ��ʾ��һ�������£����ɵõ�NaClO3��
(7)��_____��(����)�ɵõ�KH2PO4��д������ClO3-�ĵ缫��Ӧʽ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��ͬѧ�� NaHCO3��KHCO3��ɵ�ij���Ȼ�������ʵ�飬�����������(��������ʵ���Ũ�����)
ʵ����� | I | II | III |
�������(mL) | 100.0 | 100.0 | 100.0 |
��Ʒ����/g | 9.2 | 15.7 | 27.6 |
CO2���/L (��״��) | 2.24 | 3.36 | 3.36 |
(1)����������ʵ���Ũ��Ϊ______mol��L��1
(2)ʹ����ǡ����ȫ��Ӧ������Ҫ����Ʒ����Ϊ______g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���ܸ� AB ���˷ֱ���������ͬ��������ȵĿ���ͭ��Ϳ��������ڸ� �˲�ʹ����ˮ�б���ƽ�⣬Ȼ��С�ĵ����ձ��������Ũ CuSO4 ��Һ��һ��ʱ������� �йظܸ˵�ƫ���ж���ȷ����(ʵ������У���������˿��Ӧ������ĸ����仯)
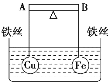
A. �ܸ�Ϊ����;�Ե��ʱ����Ϊ A �˸� B �˵�
B. �ܸ�Ϊ����;�Ե��ʱ����Ϊ A �˵� B �˸�
C. ���ܸ�Ϊ��Ե��ʱ��A �˵� B �˸ߣ�Ϊ����ʱ��A �˸� B �˵�
D. ���ܸ�Ϊ��Ե��ʱ��A �˸� B �˵ͣ�Ϊ����ʱ��A �˵� B �˸�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڽ���Ԫ�ؼ�~����Ԫ�����ڱ��е����λ�����ұ���ʾ�������ж���ȷ����

A. ԭ�Ӱ뾶������������B. �����ԣ��ף���
C. ����������ԣ�����������D. �������������ף���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2�۵�Ϊ-59.5�棬�е�Ϊ11.0�棬�¶ȹ��߿�������ը��������ˮ�������Һ��Ӧ����ҵ���ó�ʪ��KClO3�Ͳ���(H2C2O4)��60��ʱ��Ӧ�Ƶá�ijͬѧ�������ͼװ������ȡ���ռ�ClO2���ⶨ��������

ʵ��I����ȡ���ռ�ClO2��װ����ͼ��ʾ��
(1)װ��A���ƾ����⣬����������__________װ�ã�Ŀ����____________��װ��BӦ������_____________(������ˮԡ��������ˮԡ������60�����ˮԡ��)װ�á�
(2)װ��A�з�Ӧ������K2CO3��ClO2��CO2�ȣ���д���÷�Ӧ�Ļ�ѧ����ʽ_____________��
ʵ��II���ⶨClO2��������װ����ͼ��ʾ���������£�

������ƿ�м��������ĵ⻯�أ���100mLˮ�ܽ���ټ�![]() ������Һ��
������Һ��
�ڰ�����ͼ��װ���������ڲ���Һ����м���ˮ����û���ܿڣ�
�۽����ɵ�ClO2�����ɵ���ͨ����ƿ����Һ�У�������պѲ���Һ����е�ˮ��Һ������ƿ�У�������ƿ�м��뼸�ε�����Һ��
����cmol/L Na2S2O3��Һ�ζ���ƿ�е�Һ�壬����ȥVmL Na2S2O3��Һ(��֪��I2+2S2O32-=2I-+S4O62-)��
(3)װ���в���Һ��ܵ�������______________��
(4)�ζ��յ��������___________________��
(5)���ͨ��ClO2������m (ClO2)=_______![]() (���������ĺ�
(���������ĺ�![]() �Ĵ���ʽ��ʾ)��
�Ĵ���ʽ��ʾ)��
(6)�ж����в�����m (ClO2)�ⶨ�����Ӱ��(����ƫ��������ƫ����������Ӱ����)��
����������Na2S2O3����Һʱ���ձ��е���Һ��������������ⶨ���________��
�����ڵζ��յ��ȡ�ζ��̶ܿ�ʱ�����ӱ�ҺҺ�棬��ⶨ���_________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com