
��9�֣������ǹ�ҵ����Ҫ��ԭ�ϡ�
��1���������ڹ�ҵ�ϳɰ� N2(g) + 3H2(g)
 2NH3(g)����H = -92.2 kJ��mol-1��
2NH3(g)����H = -92.2 kJ��mol-1��
��һ���¶��£����ݻ��㶨���ܱ������У�һ������N2��H2��Ӧ�ﵽƽ��ı�ijһ�����������Ӧ������ʱ��Ĺ�ϵ����ͼ��ʾ������t2 �pt4 �pt5 �pt7ʱ������Ӧ��ʵ�������ı�ֱ���
t2 t4 t5 t7 ��

���¶�ΪT��ʱ����2amolH2��amolN2����0.5L�ܱ������У���ַ�Ӧ����N2��ת����Ϊ50������ʱ�ų�����46.1 kJ������¶��·�Ӧ��ƽ�ⳣ��Ϊ ��
��2�����ݻ���ͬ�����ܱ�����A��B�У������¶�Ϊ423K��ͬʱ��A��B�зֱ����1mol��2mol�⻯�����Ӧ��2HI(g) H2(g)+I2(g) �ﵽƽ���ƽ��ʱI2��Ũ��c(I2)A
c(I2)B ��ƽ��ʱHI�ķֽ��ʦ�A
��B ��ƽ��ʱH2�ڻ�������е��������A
B �����������������������
H2(g)+I2(g) �ﵽƽ���ƽ��ʱI2��Ũ��c(I2)A
c(I2)B ��ƽ��ʱHI�ķֽ��ʦ�A
��B ��ƽ��ʱH2�ڻ�������е��������A
B �����������������������
(9��)��1����t2 ����N2��H2��Ũ��t4 �������
t5 ��СNH3Ũ�� t7 ���� �� 4.0 ��2�֣�
��2�� �� �� �� �� �� ������1��1�գ�
����������1����t2ʱ������Ӧ���������淴Ӧ���ʲ��䣬˵���������˷�Ӧ���Ũ�ȣ�t4ʱ�������ʵȱ�������˵�����Ǽ��˴�����ͬ����t5�Ǽ����˲���Ũ�����£�t7ʱ���������ʶ���С�����������Ӧ���ʴ�˵�������ƶ���Ӧ���ǽ����¶����¡�
��N2(g)
+ 3H2(g)  2NH3(g)����H =
-92.2 kJ��mol-1
2NH3(g)����H =
-92.2 kJ��mol-1
0.5a 1.5a a -46.21kJ
��֪��a=1��
N2(g) + 3H2(g)  2NH3(g)
2NH3(g)
��ʼn�� 1 2 0
��n: 0.5 1.5 1
ƽ��n�� 0.5 0.5 1
��
��2��������ͼ��ʾ��
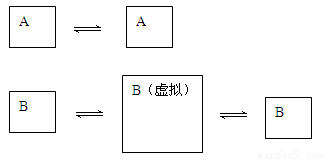
��ʼ̬ ƽ��
�ɰ�B���ݻ�����һ���������һ��B��ƽ��״̬����Ӧ����A��ƽ��״̬��ȣ����������һ�����⣬������������ʵ���Ũ�ȡ�ת������ȫ���ϣ��ٰ�����������״̬ѹ��������̬������ƽ�����ߵ�����ϵ������ȣ���ƽ�ⲻ�ƶ�����������Ũ��Ӧ����Aƽ��״̬��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ���� |
| ||
| ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| һ������ |
| ʱ��/min | 0 | 30 | 70 | 80 | 100 |
| n��CO2��/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꼪��ʡ�����и�����ѧ����ĩ��ϰ��⻯ѧ�Ծ��������棩 ���ͣ������
�״���һ����Ҫ�Ŀ�������Դ����ҵ�Ͽ���CO��H2�ϳɡ�
��1����֪��CO(g)��1/2O2(g)��CO2(g) ��H����283 kJ��mol��1
CH3OH(l)��3/2O2(g)��CO2(g) ��2H2O(l) ��H����725kJ��mol��1
��Ҫ���CO(g)��2H2(g)��CH3OH(l)�ġ�H������Ҫ֪����Ӧ���û�ѧ����ʽ��ʾ�� ���ʱ䡣
��2����Cu2O/ZnO�������������£���CO(g)��H2(g)�����ݻ�Ϊ2L���ܱ������кϳ�CH3OH(g)����Ӧ�����У�CH3OH�����ʵ�����n����ʱ�䣨t�����¶ȵĹ�ϵ��ͼ��

��������ش��������⣺
�ٷ�Ӧ�ﵽƽ��ʱ��ƽ�ⳣ������ʽK�� ��
�����¶ȣ�Kֵ �����������С��
���䡱����
����500�棬�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2) �� ��
���������������䣬�Դ���Z�����ϵ�������ѹ����ԭ����1/2���ﵽ�µ�ƽ��������йظ���ϵ��˵����ȷ���� ��
a��������Ũ����ԭƽ��ȼ��� b�������淴Ӧ���ʶ��ӿ�
c���״������ʵ������� d������ƽ��ʱn(H2) /n(CH3OH)����
�ܾ��о�����Ӧ������������õ�ΪCu2O����Ӧ��ϵ�к�������CO2������ά��Cu2O�������䣬ԭ���ǣ� ��д����صĻ�ѧ����ʽ�����Ա�Ҫ������˵������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�����ʡ�����б�ҵ��������飨һ����ѧ�Ծ��������棩 ���ͣ������
������һ����Ҫ�Ļ�����Ʒ����������Ρ����صȵ�ԭ�ϡ���ҵ�ϳɰ��ķ�Ӧ����:N2(g) +3H2(g)  2NH3(g)
��H=һ92. 4 KJ��mol-1
2NH3(g)
��H=һ92. 4 KJ��mol-1
��1��2NH3(g)  N2(g)
+3H2(g)�ں����ܱ������дﵽƽ��ı�־��
N2(g)
+3H2(g)�ں����ܱ������дﵽƽ��ı�־��
�ٵ�λʱ��������3n mol H2:ͬʱ����2n mol NH3����NH3��N2��H2��ʾ��Ӧ���ʱ�Ϊ2��1��3 �ۻ��������ܶȲ��ٸı� �ܻ������ѹǿ���ٸı� �ݻ������ƽ����Է����������ٸı�
A.�٢ۢ� B.�٢ڢܢ� C.�٢ܢ� D.�ڢۢ�
��2����ҵ�ϳ���CO2��NH3ͨ�����·�Ӧ�ϳ�����[CO(NH2)2]��

t��ʱ�����ݻ��㶨Ϊ2L���ܱ������м���0.10 molCO:��0. 40 molNH3 ,70 min��ʼ�ﵽƽ�⡣��Ӧ��CO2 ( g)�����ʵ�����ʱ��仯���±���ʾ:
|
ʱ�䣯min |
��0 |
30 |
70 |
80 |
100 |
|
n(CO2) ��mol |
0.10 |
0.060 |
0.040 |
0.040 |
0.040 |
��20 minʱ������(CO2 )_����������80 minʱ������(H2O)(�>������=����<��)��
����100 minʱ�����������������䣬���������г���0. 050 mo1CO2��0. 20 molNH3�����½���ƽ���CO2��ת������ԭƽ����Ƚ�_ (����������䡱��С��)��
���������淴Ӧ��ƽ�ⳣ��Ϊ_ (������λС��)��
�ܸ��ݱ���������ͼ���л��Ƴ���t����NH3��ת������ʱ��仯��ͼ��;����������������;��(t+10)������ȷ��ͼ������� (��ͼ���еġ�A����B��)��

��ͼ����ʾװ��(����������Ϊ���Ե缫)�����ڵ�����ء�CO(NH2)2���ļ�����Һ��ȡ��������װ���������ĵ缫��ӦʽΪ �����������ռ�������22. 4L(��
��)�������ĵ�����Ϊ g(����������ܽ�)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com