
【题目】下列描述的化学反应状态,不一定是平衡状态的是( )
A.H2(g)+Br2(g) ![]() 2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
B.2NO2(g) ![]() N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
C.CaCO3(s)![]() CO2(g)+ CaO(s),恒温、恒容下,反应体系中气体的密度保持不变
CO2(g)+ CaO(s),恒温、恒容下,反应体系中气体的密度保持不变
D.N2(g)+3H2(g) ![]() 2NH3(g),反应体系中H2与N2的物质的量之比保持3:1
2NH3(g),反应体系中H2与N2的物质的量之比保持3:1
【答案】D
【解析】
A.H2(g)+Br2(g) ![]() 2HBr(g)恒温、恒容下,反应体系中气体的颜色保持不变,说明溴单质的浓度不再变化,达到了平衡,故A错误;
2HBr(g)恒温、恒容下,反应体系中气体的颜色保持不变,说明溴单质的浓度不再变化,达到了平衡,故A错误;
B.2NO2(g) ![]() N2O4(g)是前后气体系数和变化的反应,当恒温、恒容下,反应体系中气体的压强保持不变,达到了平衡,故B错误;
N2O4(g)是前后气体系数和变化的反应,当恒温、恒容下,反应体系中气体的压强保持不变,达到了平衡,故B错误;
C.CaCO3(s)![]() CO2(g)+ CaO(s)恒温、恒容下,反应体系中气体的密度等于气体质量和体积的比值,质量变化,体积不变,所以密度变化,当气体密度保持不变的状态是平衡状态,故C错误;
CO2(g)+ CaO(s)恒温、恒容下,反应体系中气体的密度等于气体质量和体积的比值,质量变化,体积不变,所以密度变化,当气体密度保持不变的状态是平衡状态,故C错误;
D.N2(g)+3H2(g) ![]() 2NH3(g)反应体系中H2与N2的物质的量之比保持3:1,不能证明正逆反应速率相等,不一定是平衡状态,故D正确;
2NH3(g)反应体系中H2与N2的物质的量之比保持3:1,不能证明正逆反应速率相等,不一定是平衡状态,故D正确;
故选:D。


科目:高中化学 来源: 题型:
【题目】以乙烯为原料,可以制备乙酸乙酯
![]()
(1) ③的反应类型是_________,乙醇分子中官能团的名称是 _______________ 。
(2) 写出反应①的化学方程式____________________________________________。
(3)利用图示装置制取乙酸乙酯。写出生成乙酸乙酯的化学方程式:__________________________。
(4)如图实验操作中,将产物通入饱和碳酸钠溶液中,导管不能插入到碳酸钠溶液中是为了防止:_______,饱和碳酸钠溶液的作用是:_________________________________________。
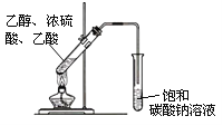
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子结构中各种化学键如下图所示,关于乙醇在各种反应中断裂键的说明不正确的是( )
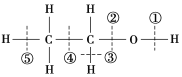
A. 和金属钠反应时键①断裂
B. 和浓硫酸共热到170 ℃时断键②和⑤
C. 和浓硫酸共热到140 ℃时断键②,其他键不断
D. 在银催化加热下与O2反应时断键①和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为室温时不同pH下磷酸盐溶液中含磷微粒形态的分布,其中a、b、c三点对应的pH分别为2.12、7.21、11.31,其中δ表示含磷微粒的物质的量分数,下列说法正确的是______
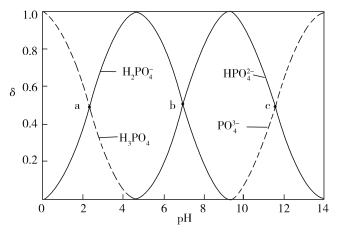
A.2 mol H3PO4与3 mol NaOH反应后的溶液呈中性
B.NaOH溶液滴定Na2HPO4溶液时,无法用酚酞指示终点
C.H3PO4的二级电离常数的数量级为107
D.溶液中除OH离子外,其他阴离子浓度相等时,溶液可能显酸性、中性或碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
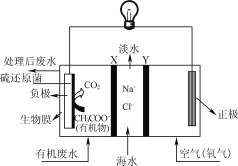
A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1。E原子最外层电子数是D原子最外层电子数的4倍,D的简单离子核外电子排布与C2-相同。

试回答:
(1)元素E在元素周期表中的位置是________。
(2)与元素D的简单离子所含电子数和质子数均相同的微粒是________(用化学式作答,下同)。
(3)B和E的最高价氧化物对应的水化物,酸性较弱的为________。若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ________Ⅱ________,观察到的实验现象是____。
(4)由以上五种元素组成的中学常见的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A、C、D的盐 |
b | C、D组成的化合物,且原子个数之比为1∶1 |
c | 化学组成为AC2 |
①a含有的化学键有____________________________________;
②c的电子式为___________________;
③b与c反应的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H =-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H =+116.49 kJ·mol-1
③H2O(l)=H2O(g)△H =+88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式______________。
(2)已知:
化学键 | Si—Cl | H—H | H—Cl | Si—Si |
键能/kJ·mol-1 | 360 | 436 | 431 | 176 |
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键。工业上所用的高纯硅可通过下列应反制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的△H=___ kJ·mol-1。
Si(s)+4HCl(g),该反应的△H=___ kJ·mol-1。
(3)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为_____、_____,CO2的平衡转化率为______。
CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为_____、_____,CO2的平衡转化率为______。
(4)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为
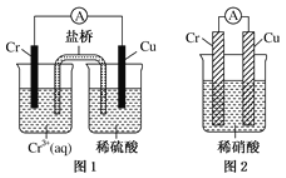
① ____________________________________。
② ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物①在一定条件下可以制备②,下列说法错误的是
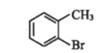 ①→
①→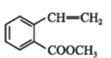 ②
②
A.①不易溶于水
B.①的芳香族同分异构体有3种(不包括①)
C.②在碱性条件下的水解是我们常说的皂化反应
D.②中所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有H+、Mg2+、Al3+三种阳离子,逐滴加入0.1mol/L NaOH溶液,消耗NaOH溶液体积和生成沉淀关系如图,则下列说法正确的是( )
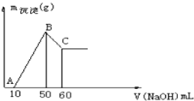
A. 横坐标为0-50mL时,所有反应为:Mg2++2OH-=Mg(OH)2↓ Al3++3OH-=Al(OH)3↓
B. B点生成沉淀的总物质的量0.02mol
C. 若往C点的溶液中加入足量盐酸,沉淀将全部溶解
D. H+、Mg2+、Al3+三种阳离子物质的量浓度之比为:2:2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com