
【题目】现有三种液态混合物:①乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃);②汽油和水;③溴水。在实验室分离这三种混合物的正确方法依次为
A.蒸馏、分液、萃取 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】在给定的四种溶液中加入以下各种离子,能在原溶液中大量共存的是
A. 常温下pH=1 的溶液: K+、HCO3-、Br、Ba2+
B. 滴加酚酞溶液显红色的溶液:Fe3+、NH4+、Cl、NO3-
C. 所含溶质为FeCl3的溶液:K+、SO42-、NO3-、H+
D. 强碱性溶液:Cu2+、Na+、Mg2+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为:S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
A. 该反应中的还原剂为KNO3
B. 该反应中C被还原
C. 若消耗32g S,该反应转移电子数为2 NA
D. 若生成标准状况下气体22.4L,则有0.75 mol物质被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成神经抑制剂F的一种路线如图所示:
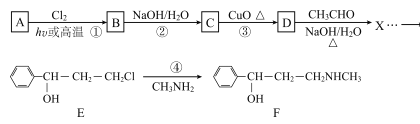
已知:![]()
请回答下列问题:
(1)已知芳香烃A的相对分子质量为92,A的结构简式为____;B的系统命名是___ ;C中含氧官能团的名称是____。
(2)反应③的化学反应方程式为____;①~④中属于取代反应的是____。
(3)D分子中最多有____个原子共平面。
(4)④的反应中,因反应温度控制不当,常常有副产物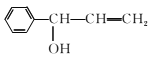 生成,写出可能的副反应方程式____。
生成,写出可能的副反应方程式____。
(5)包含C在内,C的同分异构体中芳香族化合物共有____种,其中满足下列条件同分异构体的结构简式为____。
①能使FeCl3溶液显色,②核磁共振氢谱上有4组峰,且峰面积之比为3:2:2:1。
(6)已知-CHO与RNH2易发生反应,现以中间体X为原料,设计出制备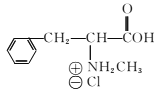 的合成路线(无机试剂自选):________________________________________
的合成路线(无机试剂自选):________________________________________
流程示例:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍钴锰三元材料是近年来开发的一类新型锂离子电池正极材料,具有容量高、循环稳定性好、成本适中等重要优点。镍钴锰三元材料中Ni为主要活泼元素,通常可以表示为:LiNiaCobMncO2,其中a+b+c=1,可简写为LiAO2。充电时总反应为LiAO2 + nC = Li1-xAO2 + LixCn(0<x<1),工作原理如下图所示,则以下说法正确的是( )
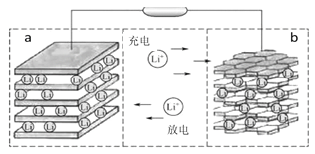
A. 放电时Ni元素最先失去电子
B. 放电时电子从a电极由导线移向b电极
C. 充电时的阳极反应式为LiAO2 - xe-= Li1-xAO2 + xLi+
D. 充电时转移1mol电子,理论上阴极材料质量增加7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.离子键就是使阴、阳离子通过共用电子对而形成的
B.只有活泼金属与活泼非金属之间才能形成离子键
C.离子化合物受热熔化时可以导电
D.离子化合物溶解时,离子键不被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,①6.72L NH3 ②1.204×1023个 H2S ③6.4g CH4 ④0.5mol HCl ,下列关系正确的是
A. 体积大小: ④>③>②>① B. 原子数目: ③>①>④>②
C. 密度大小: ④>②>③>① D. 质量大小: ④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组根据镁与CO2的反应设计实验探究镁与NO2的反应。
甲同学推测产物是MgO和N2;
乙同学推测产物除了MgO和N2外,固体中还可能含有Y。
该小组同学设计了以下装置探究镁与NO2反应的固体产物,并测定其组成。

(1)实验开始时,先关闭止水夹后打开弹簧夹,再打开分液漏斗活塞,当硬质玻璃管充满红综色气体后,打开止水夹,关闭弹簧夹,最后点燃酒精灯。这样做的目的是___________________________________________________________
(2)装置B中的试剂可以选用________
A、浓硫酸 B、无水氯化钙 C、五氧化二磷 D、碱石灰
(3)装置C中盛装氢氧化钠溶液的作用是:___________________________________
(4)为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是①气体恢复至室温再读数;②_______________________________;③______________________________。
(5)实验结束后,同学们将固体产物取出与水反应,发现有刺激性气味的气体产生,该气体能使湿润的石蕊试纸变蓝。说明乙组同学推测正确,请写出Y与水反应的化学方程式__________________________________
(6)若初始加入镁粉质量为3.6 g,在足量的NO2中充分反应后 ,收集到N2体积为448mL (标准状况),则产物中MgO的质量是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、下表是某研究性学习小组探究稀硫酸与金属锌反应的实验数据:

实验数据可发现有一个数据明显有错误,该数据是实验________(填实验序号),理由是_______________________________________________
Ⅱ、在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0
2SO3(g) △H<0
(1)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是___________。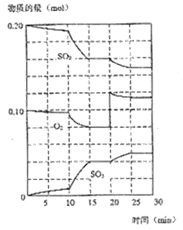
(2)据图判断,反应进行至20min时,曲线发生变化的原因是__________(用文字表达);10min到15min的曲线变化的原因可能是_____________(填写编号)。
A. 加了催化剂 B. 缩小容器体积
C. 降低温度 D. 增加SO3的物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com