
【题目】Ca3N2某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。

(1)仪器B的名称是_____________,B中固体物质为_______________。
(2)反应过程中末端导管必须插入试管C的水中,目的是______。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(3)将制备氮化钙的操作步骤补充完整:
①打开活塞K并通入N2;
②点燃酒精灯,进行反应;
③反应结束后,__________________。
(4)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=______。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_________________,设计实验检验Ca3N2与水反应产物的操作及现象__________________。
【答案】 干燥管 碱石灰(无水氯化钙,其他答案合理即可) BC 熄灭酒精灯,冷却至室温后,再停止通入氮气 2.8 Ca3N2+6H2O=3Ca(OH)2+2NH3 取少量氮化钙于一洁净试管中,加入适量水,将湿润的红色石蕊试纸放在管口,若变蓝证明有氨气,反应一段时间后,再向试管中滴加碳酸钠溶液,若有白色沉淀证明有氢氧化钙。(其他答案合理即可)
【解析】(1)仪器B为干燥管,目的是防止外界水蒸气加入装置,应该选用固体干燥剂,可以是碱石灰等,故答案为:干燥管; 碱石灰或无水氯化钙等;
(2)反应过程中末端导管必须插入试管C的水中,可以防止空气从导管进入装置而与钙发生反应,所以,反应过程中末端导管必须插入试管的水中目的是:液封,防止空气中的氧气通过末端导管进入实验装置;同时便于观察氮气流速,故选BC;
(3)根据制备氮化钙的操作步骤:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后,熄灭酒精灯,冷却至室温后,再停止通入氮气,故答案为:熄灭酒精灯,冷却至室温后,再停止通入氮气;
(4) ①参加反应钙的质量=15.08g-14.80g=0.28g,参加反应的氮元素 的质量为:15.15g-15.08g=0.07g
xCa + N2 ═CaxN2
40x 28
0.28g 0.07g
![]() =
=![]() ,解得:x=2.8,故答案为:2.8;
,解得:x=2.8,故答案为:2.8;
②Ca3N2与水强烈反应生成氢氧化钙和氨气,反应的化学方程式为Ca3N2+6H2O=3Ca(OH)2+2NH3,检验Ca3N2与水反应产物氢氧化钙和氨气,可以取少量氮化钙于一洁净试管中,加入适量水,将湿润的红色石蕊试纸放在管口,若变蓝证明有氨气,反应一段时间后,再向试管中滴加碳酸钠溶液,若有白色沉淀证明有氢氧化钙,故答案为:Ca3N2+6H2O=3Ca(OH)2+2NH3;取少量氮化钙于一洁净试管中,加入适量水,将湿润的红色石蕊试纸放在管口,若变蓝证明有氨气,反应一段时间后,再向试管中滴加碳酸钠溶液,若有白色沉淀证明有氢氧化钙。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】金华市金东区环保部门为了使农村生活垃圾得到合理利用,在全国率先实施了生活垃圾分类投放的办法。其中塑料袋、废纸、旧橡胶制品等属于
A. 无机物 B. 有机物 C. 盐类 D. 非金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列问题:
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:
该元素核外价电子排布图_____________,电子排布式_____________________。该元素的原子序数为______,该元素是______元素(填“金属”或“非金属”),形成的单质为______晶体。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:_________、__________、________。
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。_____
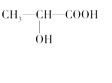
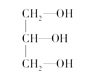
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧、PCl3中,属于非极性分子的是(填番号)________________。
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4________H2SO3; HClO3________HClO4; H3PO4________H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
①NH3中心原子的杂化方式为______杂化,VSEPR构型为__________,分子的立体构型为__________________。
②BF3分子中,中心原子的杂化方式为________杂化,分子的立体构型为____________。
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. NaHCO3的水解方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 醋酸铵的电离:CH3COONH4![]() CH3COO-+NH4+
CH3COO-+NH4+
C. 氯化银的溶解平衡表达式:AgCl(s) ![]() Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
D. 汽车尾气净化反应2NO+2CO=2CO2+N2能够自发进行,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
向盛有硫酸铜水溶液的试管里加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解病得到深蓝色的透明液体;若向试管中加入一定量乙醇,析出深蓝色晶体。结合有关知识,回答下列问题:
(1)Cu、N、O、S元素第一电离能由大到小的顺序是_______(填元素符号);蓝色沉淀溶解时发生反应的离子方程式是________________。
(2)请解释加入乙醇后析出晶体的原因______________。
(3)SO42-的空间构型是_____________,其中S原子的杂化轨道类型是___________。
(4)NH3、H2O分子中,键角的大小顺序为_______(用分子式表示);NH3极易溶于H2O的原因,除了两种分子都是极性分子外,还因为_______________。
(5)Cu和O能形成一种化合物,其晶胞结构如图所示,则R所表示微粒的价电子排布式为_____;若相邻的两不同微粒间的距离为a cm,设阿伏伽德罗常数的数值为NA,则该晶体的密度为_______(用含a、NA的代数式表示)g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表的一部分,请参照①~⑨在表中的位置,回答下列问题:

(1)②的元素符号是__________,⑥在周期表中的位置是___________。
(2)⑦、⑧两元素比较,非金属性强的是(填元素符号)_______,从原子结构角度解释原因_________。
(3)④-⑥这三种元素中,写出最高价氧化物对应水化物两两之间能反应的离子方程式____________________。
(4)写出工业冶炼元素⑤单质的化学方程式_________,不选择热还原法冶炼这种活泼金属的原因是___________________。
(5)元素①和③可以组成很多种物质,写出其中原子个数比为1:4的物质的电子式______,请从化学键角度解释该物质中原子个数比为1:4的原因________________。
(6)已知Se在周期表中的位置如图所示,请画出Se的原子结构示意图________。
请任意写出三种Se物质的化学式,预测其性质(一条即可),并说明预测依据,完成在下列表格中。________
含Se物质化学式 | 性质 | 预测依据 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示:[已知:2SO2(g)+O2(g) ![]() 2SO3(g);△H=-196.9kJ/mol]
2SO3(g);△H=-196.9kJ/mol]

请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:_______________________;△H2=_______________;
(2)恒温恒容时,1molSO2和2molO2充分反应,放出热量的数值比|△H2|______(填 “大”、“小”或“相等”).
(3)恒容条件下,下列措施中能使n(SO3)/n(SO2)增大的有______。
a.升高温度 b.充入He气 c.再充入1molSO2(g)和1molO2(g) d.使用催化剂
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是______;图中表示平衡混合物中SO3的含量最高的一段时间是______。
(5)含硫废弃的脱硫减排是减少大气中含硫化合物污染的关键,工业脱除废气中SO2的原理如下:

①用纯碱溶液吸收SO2,将其转化为HSO3-,该反应的离子方程式为___________________________;
②若石灰乳过量,将其产物再导入吸收池,其中可用于吸收SO2的物质的电子式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知海水中溴元素主要以Br-形式存在,工业上从海水中提取溴的流程如下:

资料:溴单质容易挥发。
(1)写出“氧化”时的离子方程式_______。
(2)写出第1步“吸收”时的离子方程式________________,该反应体现了SO2的____性。
(3)得到的“含Br2溶液”通过以下不同操作,都可得到溴单质:
① 直接蒸馏得到溴单质,该操作利用的是溴的何种性质:___________;
② 加入四氯化碳萃取,将得到的溴的四氯化碳溶液蒸馏得到溴单质。可以用四氯化碳对溴溶液进行萃取利用的是溴的何种性质:_______________。
(4)对虚线框中的流程进行整体分析,完整说明该流程中所有操作的目的是___________。
(5)工业可用Na2CO3溶液代替二氧化硫的水溶液吸收Br2,完成下列化学反应方程式:
___Br2+___Na2CO3=___NaBrO3+____CO2+__ ______
若有480g溴完全反应,转移电子的物质的量为__________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.所有卤代烃都难溶于水,且都是密度比水大的液体
B.所有卤代烃都是通过取代反应制得
C.卤代烃不属于烃类
D.卤代烃都可发生消去反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com