
【题目】设![]() 为阿伏加德罗常数值。下列有关叙述正确的是
为阿伏加德罗常数值。下列有关叙述正确的是![]()
![]()
A.电解精炼粗铜![]() 含有锌铁等杂质
含有锌铁等杂质![]() ,若阳极溶解32g铜,转移电子数目为
,若阳极溶解32g铜,转移电子数目为![]()
B.![]() 分子结构如图
分子结构如图![]() 含
含![]() 键数为
键数为![]()

C.某温度下,![]() 的
的![]() 溶液中含有的
溶液中含有的![]() 数目为
数目为![]()
D.氢氧燃料电池正极消耗![]() 气体时,负极消耗的气体分子数目为
气体时,负极消耗的气体分子数目为![]()
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C. pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. 向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中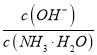 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
(1)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1 NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=________。
(2)25℃时,H2SO3![]() HSO3-+H+的电离常数Ka=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中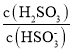 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(3)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)
H++A2-。常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) △H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
Ca2+(aq)+A2-(aq) △H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数,下列叙述正确的是
为阿伏加德罗常数,下列叙述正确的是![]()
![]()
A.过氧化钠与水反应时,生成![]() 转移的电子数为
转移的电子数为![]()
B.![]() 用NaOH溶液充分吸收,转移的电子数目为
用NaOH溶液充分吸收,转移的电子数目为![]()
C.常温常压下,![]() 和
和![]() 混合,生成气体分子数目为
混合,生成气体分子数目为![]()
D.常温常压下,![]() 与足量的铁屑反应转移电子数目为
与足量的铁屑反应转移电子数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸在水溶液中存在下列电离平衡:CH3COOH![]() CH3COO+H+,下列说法不正确的是
CH3COO+H+,下列说法不正确的是
A.加入醋酸钠晶体后,溶液的pH增大
B.加入碳酸钠,平衡向右移动
C.加水稀释,溶液中c(H+)和c(OH-)均减少
D.升高温度,Ka(CH3COOH)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、As的化合物。由黑钨矿冶炼钨的工艺流程如图1:
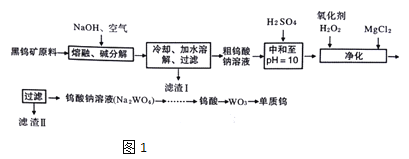
已知:
①滤渣I的主要成份是Fe2O3、MnO2
②上述流程中,钨的化合价只有在最后一步发生改变。
③常温下钨酸难溶于水。
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为___,请写出MnWO4在熔融条件下发生碱分解反应生成Fe2O3的化学方程式___
(2)上述流程中向粗钨酸钠溶液中加硫酸中和至pH=10后,溶液中的杂质阴离子确SiO32-、HAsO32-、HAsO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为___,滤渣Ⅱ的主要成分是___
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。图2为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:

①T1___T2(填“>”或“<”)T1时Ksp(CaWO4)=___
②将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,物质的量浓度均为0.1molL-1的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)用离子方程式解释溶液⑤能去除油污的原因_____。
(2)写出溶液④中通少量CO2的离子方程式:_____。
(3)25℃时,溶液①中,由水电离产生的c(H+)=_____molL﹣1,
(4)①0.100molL-1NH4HCO3溶液中物质的量浓度最大的离子是__________(填化学式);②CH3COOH与NaOH反应后的溶液中存在:c(Na+)<c(CH3COO-),该溶液呈_________性(填“酸”“碱”或“中”),该溶液的溶质是______。(填化学式)
(5)下列说法正确的是_____。
a.c(NH4+):①>②
b.物质的量浓度和体积均相等的NaCl和NaX两种溶液中,离子总数相等
c.等体积的③和⑤形成的混合溶液中:c(HCO3-)+c(CO32-)=0.1molL-1
d.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
(6)某同学欲用0.1molL-1 CaCl2溶液来鉴别溶液③和⑤,当他将CaCl2溶液滴入装有溶液③的试管中时,出现了意想不到的现象:试管中出现了白色沉淀,并伴有气体生成。试解释产生上述现象的原因:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol·L-lNaCl溶液和10 mL 0.1 mol·L-lK2CrO4溶液中分别滴加0.1 mol·L-lAgNO3溶液。滴加过程中pM[-lgc(Cl-)或-lgc(CrO42-)]与所加AgNO3溶液体积之间的关系如下图所示。已知Ag2CrO4为红棕色沉淀。下列说法错误的是

A. 该温度下,Ksp(Ag2CrO4)=4×10-12
B. al、b、c三点所示溶液中c(Ag+):al>b>c
C. 若将上述NaCl溶液浓度改为0.2mol·L-1,则a1点会平移至a2点
D. 用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式表达正确的是( )
A. 明矾溶液中滴加Ba(OH)2溶液至SO42-完全沉淀:Al3++Ba2++SO42-+3OH-=BaSO4↓+Al(OH)3↓
B. 将铁粉加入到稀硫酸种:2Fe+6H+=2Fe3++3H2↑
C. 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+=2Fe3++2H2O
D. NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com