
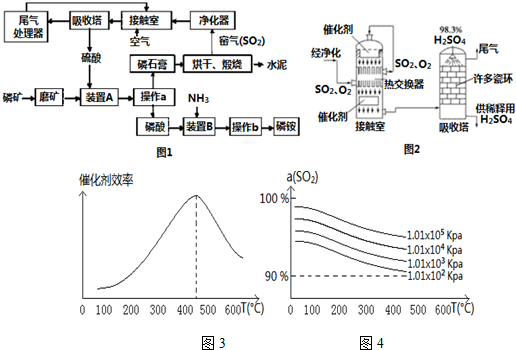
分析 装置A中硫酸与磷矿反应,操作a是把固体与液体分开,应为过滤,装置B中氨气与磷酸反应,操作b是由溶液中析出晶体,应经过蒸发浓缩、冷却结晶等操作得到磷铵,磷酸受热容易分解,在结晶时应采用低温蒸发结晶.磷石膏中含有硫酸钙,经过煅烧生成水泥,得到二氧化硫窑气,净化后得二氧化硫,在接触室中氧化得三氧化硫,与水反应得硫酸,可以再参加与磷矿石的反应,尾气中二氧化硫循环利用.
(1)未净化的SO2气体中有粉尘等杂质,可以使催化剂中毒;
(2)增大SO3与吸收剂的接触面积;
(3)400℃~500℃、101KPa时二氧化硫的转化率已经很高,再增大压强,会增大成本,二氧化硫转化率提高不大;
(4)SO2、微量的SO3和酸雾都能与碱反应,不能利用碱测定,SO2具有还原性,可以利用强氧化剂测定;
(5)由上述分析可知,硫酸、二氧化硫可以循环利用;
(6)磷铵是一种常用复合肥,经分析其中氮与磷原子数之比为3:2,磷铵的化学式可以表示为:(NH4)3H3(PO4)2,根据P元素守恒可得关系式:2P~(NH4)3H3(PO4)2,根据关系式计算.
解答 解:装置A中硫酸与磷矿反应,操作a是把固体与液体分开,应为过滤,装置B中氨气与磷酸反应,操作b是由溶液中析出晶体,应经过蒸发浓缩、冷却结晶等操作得到磷铵,磷酸受热容易分解,在结晶时应采用低温蒸发结晶.磷石膏中含有硫酸钙,经过煅烧生成水泥,得到二氧化硫窑气,净化后得二氧化硫,在接触室中氧化得三氧化硫,与水反应得硫酸,可以再参加与磷矿石的反应,尾气中二氧化硫循环利用.
(1)未净化的SO2气体中有粉尘等杂质,可以使催化剂中毒,
故答案为:防止接触室中的催化剂中毒;
(2)操作b是从溶液中获得晶体,从溶液中析出晶体的方法是:将溶液蒸发浓缩、冷却结晶可得相应晶体,
故答案为:蒸发浓缩、冷却结晶;
(3)400℃~500℃、101KPa时二氧化硫的转化率已经很高,再增大压强,会增大成本,二氧化硫转化率提高不大,该温度下反应速率较快、催化剂活性最好,
故答案为:400℃~500℃、101KPa;
(4)A.NaOH溶液与SO2、微量的SO3和酸雾反应,测量的SO2含量偏高,故A错误;
B.硫酸尾气中只有SO2能被酸性KMnO4溶液氧化,溶液颜色由紫红色变为无色,根据KMnO4溶液的体积结合方程式计算SO2的含量,故B正确;
C.氨水与SO2、微量的SO3和酸雾反应,测量的SO2含量偏高,故C错误;
D.硫酸尾气中只有SO2能被碘水氧化SO2,溶液颜色由蓝色变为无色,根据碘水溶液的体积结合方程式计算SO2的含量,故D正确,
故答案为:BD;
(5)由上述分析可知,H2SO4、SO2可以循环利用,
故答案为:H2SO4、SO2;
(6)磷铵是一种常用复合肥,经分析其中氮与磷原子数之比为3:2,磷铵的化学式可以表示为:(NH4)3H3(PO4)2,设需要磷矿y吨,则:
2P~~~~~~~(NH4)3H3(PO4)2
62 247
y吨×80%×$\frac{31×2}{310}$×(1-7%) 74.1吨
所以62:244=y吨×80%×$\frac{31×2}{310}$×(1-7%):74.1吨
解得:y=125
故答案为:125.
点评 本题考查物质的分离与提纯方法的综合应用,题目难度中等,涉及物质的分离提纯、对条件的控制、对装置与原理的分析评价、实验方案设计、化学计算等,(6)中计算为易错点、难点,关键根据原子数目之比确定磷铵的组成,试题培养了学生的分析能力及化学实验能力.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 13:8 | B. | 8:13 | C. | 16:9 | D. | 9:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
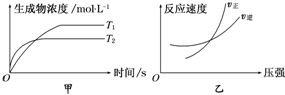
| A. | a+b>c+d T1>T2△H>0 | B. | a+b>c+d T1<T2 △H<0 | ||
| C. | a+b<c+d T1>T2△H>0 | D. | a+b>c+d T1>T2△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都加大,平衡向正反应方向移动 | |
| B. | 正、逆反应速率都没有变化,平衡不发生移动 | |
| C. | 正反应速率加大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 正反应速率减小,逆反应速率加大,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水可使pH试纸先变红,后褪色 | |
| B. | 氯水放置数天后,溶液的酸性逐渐减弱 | |
| C. | 新制的氯水只含Cl2和H2O分子 | |
| D. | 光照氯水有气泡逸出,该气体是Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g H2O含有的氢原子数目为NA | |
| B. | 标准状况下,22.4L CO2含有的分子数目为NA | |
| C. | 1L1mol•L-1Na2SO4溶液中含有钠离子数目为NA | |
| D. | 1mol H2在Cl2中完全燃烧转移的电子数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com