
X、Y、W、M、N五种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族元素氢化物的沸点高,但在同周期中却不是最高的。W是同周期元素中离子半径最小的元素。M原子的最外能层上有两个运动状态不同的电子。N是一种“明星金属”,广泛应用于航天、军事等工业领域。请回答下列问题:
⑴X、Y两种元素的元素符号是: 、 。X、Y可以形成一种共价化合物,其中两种元素最外层电子数都达到8,则其分子的空间构型是: ;中心原子的杂化方式是: 。
⑵X的氢化物易溶于水的其原因是: 。
⑶N的电子排布式是: 。
⑷X和Y两元素的第一电离能大小关系: 小于 (填元素符号)。
(1)N F三角锥 SP3 (2)氨气与水反应,氨气与水可以形成氢键,氨气分子是极性分子(3)1s22s22p63s23p63d24s2.(4)N小于F
解析试题分析:根据题意可推知这五种元素分别是:X是N;Y是F;W是Al; M 是Ca;N是Ti。(1)X、Y两种元素的元素符号是N、F。X、Y可以形成一种共价化合物,其中两种元素最外层电子数都达到8。该分子为NF3。其分子的空间构型与NH3类似,是三角锥形。中心原子N的杂化方式是SP3 。⑵X的氢化物NH3易溶于水是因为NH3是极性分子,水分子是极性分子根据相似相溶原理,以极性分子构成的物质容易溶解于由极性分子组成的物质中。而且氨气与水反应,产生一水合氨。⑶22号元素Ti的电子排布式是1s22s22p63s23p63d24s2。⑷一般情况下,同一周期的元素,元素的非金属性越强,原子的半径越小,失去电子越难。非金属性N<F,所以这两元素的第一电离能大小关系N<F。
考点:考查元素的推断、分子的空间构型、分子中原子的杂化方式、原子核外电子排布、电离能大小的比较及相似相溶原理的应用的知识。


科目:高中化学 来源: 题型:填空题
(16分)X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16。在适当条件下三种单质两两化合,可发生如右图所示变化。己知l个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个。请回答下列问题: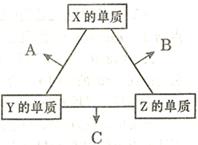
(1)由 X、Y、Z三种元素共同组成的三种不同种类的常见化合物的化学式为 ,相同浓度上述水溶液中由水电离出的c(H+)最小的是 (填写化学式)。
(2)Allis-Chalmers制造公司发现可以用C作为燃料电池的燃料,以氢氧化钾溶液为介质,反应生成对环境无污染的常见物质,试写出该电池负极的电极反应式 ,溶液中OH-向 极移动(填“正”或“负”)。
(3)Z分别与X、Y两元素可以构成18个电子分子甲和乙,其分子中只存在共价单键,常温下甲、乙均为无色液体,甲随着温度升高分解速率加快。
①乙能够将CuO还原为Cu2O,已知每lmol乙参加反应有4mole- 转移,该反应的化学方程式为 。
②将铜粉末用10%甲和3.0mol?L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol?L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)D元素在元素周期表中的位置 ,该元素常见氧化物有 和 (写出化学式)
(2)写出B、C单质生成E的化学方程式: 。
(3)12克A单质充分燃烧后的产物通人1L 1mol/LNaOH溶液中,所得溶液的溶质为 ,其物质的量为 mol。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素A、B、C、D、E的原子序数依次增大,A元素阳离子的原子核外没有电子,B是空气中含量最多的元素;C元素原子最外层电子数是其电子层数的三倍;C与D可形成两种常见的离子化合物;工业上常用电解C与E的化合物来制备E单质。
(1)画出D元素的原子结构示意图 。C、D、E的简单离子半径由小到大的顺序 (用离子符号表示)。
(2)写出元素E在周期表中的位置 。
(3)工业上常用A和B的单质合成一种常见气体,检验该气体的常用方法是 。
(4)D2C2与H2O反应的化学方程式是 ,D2C2与CuSO4溶液反应的现象是 。
(5)由元素A、B、C按原子个数比4:2:3形成的化合物,写出其电离方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑥ | | ⑦ | ⑨ | |
| 3 | ① | ③ | ⑤ | | | | ⑧ | ⑩ |
| 4 | ② | ④ | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最处层电子数相同。回答下列问题:
(1)X、Y和Z的元素符号分别为 、 、 。
(2)由上述元素组成的化合物中,既含有共价键又含有离子键的有 、 。
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是 。此化合物在酸性条件下与高锰酸钾反应的离子方程式为 ;此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | | | | | | | |
| 二 | | | | ② | | ③ | ④ | |
| 三 | ⑤ | | ⑥ | ⑦ | ⑧ | | ⑨ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原
子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1∶1的原子个数比形成的化合物的电子式: 。F的原子结构示意图为: 。
(2)B、D形成的化合物BD2中存在的化学键为 键(填“离子”或“共价”,下同)。A、C、F三种元素形成的化合物CA4F为 化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为: 。
(4)A、C、D、E的原子半径由大到小的顺序是 (用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性 于F(填“强”或“弱”),并用化学方程式证明上述结论 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素的性质或原子结构 |
| X | 最外层电子数是次外层电子数的3倍 |
| Y | 常温下单质是双原子分子,其氢化物的水溶液显碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com