
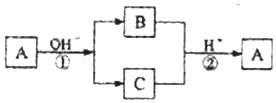
| A. | X元素可能为Al | B. | X元素可能为金属,也可能为非金属 | ||
| C. | 反应①和②互为可逆反应 | D. | 反应①和②一定为氧化还原反应 |
分析 由转化关系图可以看出,A这种单质与强碱发生反应,生成了两种产物B和C,而且B和C均含有同一种元素,且B和C又可以在强酸的作用下发生反应,生成单质A,那么可以看出反应①应该是A物质的歧化反应,反应②应该是关于一种元素的归中反应,则可以知道B和C中应该分别含有A的负价态物质以及正价态物质,则A可能为Cl2或S,应为非金属元素,以此解答该题.
解答 解:A.由以上分析可知X应为非金属元素,故A错误;
B.A可能为Cl2或S,则X为非金属,故B错误;
C.上述①②两个反应的反应条件不相同,不是可逆反应,故C错误;
D.据这两个反应特点知A元素在①反应中化合价既升高,又降低,②是BC生成单质A,一定有化合价的变化,所以①②一定为氧化还原反应,故D正确.
故选D.
点评 本题考查无机物的推断,为高频考点,侧重考查学生的分析能力,本题注意把握非金属元素的歧化反应和归中反应的特征应用,关键是理解金属无负价,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 已知HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ/mol,则含40gNaOH的稀溶液与足量稀醋酸完全中和放出的热量小于57.3kJ | |
| B. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,当有3NA个电子转移时,此反应的△H变为-46.2kJ•mol-1 | |
| C. | 已知2H2O(l)═2H2(g)+O2(g)△H=+571.6kJ•mol-1,则氢气燃烧热为285.8kJ/mol | |
| D. | 已知S(s)+O2(g)═SO2(g)△H1,S(g)+O2(g)═SO2(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配溶液时,容量瓶里有少许蒸馏水不会影响溶液浓度 | |
| B. | NaHCO3•10H2O晶体灼烧后,得到NaHCO3粉末 | |
| C. | 实验室用氯酸钾制氧气的反应不属于离子反应 | |
| D. | 要使AlCl3溶液中的Al3+离子全部沉淀出来,用氨水比用NaOH溶液好 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②③⑤ | C. | ①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 前4 s以N2O4的浓度变化表示的平均反应速率为0.01 mol•L-1•s-1 | |
| B. | 4 s时容器内的压强为开始时的1.2倍 | |
| C. | 平衡时容器内含0.4 mol N2O4 | |
| D. | 平衡时容器内含0.8 mol NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③④ | C. | ①② | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com