
| ||
| ||
| ||
| ||


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
| A、若8>m>3,则X必定为主族元素 |
| B、若Y的气态氢化物化学式为YHn,且b=4,则该氢化物为非极性分子 |
| C、若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y>X |
| D、若a=b=3,8>m>n>b,则元素非金属性:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2009年我国起征燃油税,工业上将石油分馏得到汽油,主要发生了化学变化 |
| B、2008年诺贝尔化学奖授予研究绿色荧光蛋白的科学家,区分蛋白质溶液和葡萄糖溶液可利用丁达尔效应 |
C、 “显世闻名”的奶粉事件中污染物为三聚氰胺(结构如图),其摩尔质量为l26g |
| D、2008年支援四川灾区的生活用品中食醋、纯碱、食盐的主要化学物质分别属于酸、碱、盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
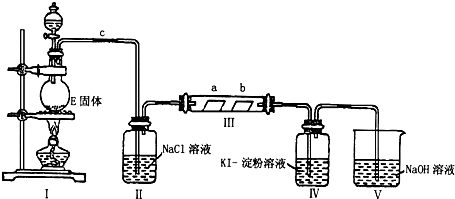
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
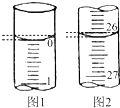 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | ① | ② |
| 第二次 | 25.00 | 1.56 | 27.68 | 26.12 |
| 第三次 | 25.00 | 0.22 | 26.30 | 26.08 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com