
| A. | 0.1mol NH3溶于足量水中(不考虑氨气挥发),溶液中N原子的数目为0.1NA | |
| B. | 标准状况下,22.4LNO与CO2的混合气体中含有O原子数为3NA | |
| C. | 58.5 g的NaCl固体中含有NA个氯化钠分子 | |
| D. | 0.1molN2与足量的H2反应,转移的电子数是0.6NA |
分析 A.依据氮原子个数守恒解答;
B.依据n=$\frac{V}{22.4}$计算物质的量,采用极值分析判断所含氧原子数;
C.氯化钠为离子晶体,不含分子;
D.合成氨的反应为可逆反应.
解答 解:A.0.1mol NH3溶于足量水,依据氮原子个数守恒可知,溶液中N原子的数目为0.1NA,故A正确;
B.标准状况下,22.4L NO与CO2的混合气体物质的量为1mol,含有O的原子数为NA~2NA之间,故B错误;
C.氯化钠为离子晶体,不含分子,故C错误;
D.合成氨的反应为可逆反应,不能进行彻底,故充分反应后转移电子的数目小于0.6NA.故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、可逆反应的特点是解题关键,题目难度不大.


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化性强弱顺序是:Fe3+>Cl2>I2>SO42- | |
| B. | 还原性强弱顺序是:SO2>I->Fe2+>Cl- | |
| C. | 反应Cl2+SO2+2H2O═2HCl+H2SO4不能发生 | |
| D. | Fe3+与I-在溶液可以大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴加KSCN溶液,若溶液出现血红色则说明原溶液中含Fe3+ | |
| B. | 向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含Ag+ | |
| C. | 向某溶液中滴加足量稀HCl,产生气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32- | |
| D. | 向某溶液中滴加NaOH溶液,除溶液体积增大外,无其它现象,说明该溶液与NaOH溶液不反应. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x的原子半径大于y的原子半径 | |
| B. | x的电负性大于y的电负性 | |
| C. | x的核电荷数大于y的核电荷数 | |
| D. | x的第一电离能小于y 的第一电离能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
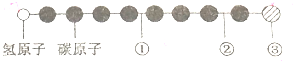 据报道,近来发现了一种新的星际分子,其分子模型如图所示(途中给球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子).下列对该物质的说法中正确的是( )
据报道,近来发现了一种新的星际分子,其分子模型如图所示(途中给球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子).下列对该物质的说法中正确的是( )| A. | ①处的化学键表示碳碳双键 | B. | 此星际分子属于烃类 | ||
| C. | ③处的原子可能是氯原子或氟原子 | D. | ②处的化学键表示碳碳单键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com