
����Ŀ���л�A�Ǻ���һ������ʯ�ͻ�ѧ��ҵ�ķ�չˮƽ��D�ķ���ʽΪC2H5Cl��C��һ�ֳ����ĸ߷ֻ������ش��������⣺

��1��д��A�Ľṹʽ___��
��2��д���ڵķ���ʽ___��;���ڡ��۶����Եõ�D������������;��___��������___��
��3��д������A��B�������ʵ�һ���Լ�___��
��4��д���ܵķ���ʽ___��
��5�����������У����˶�ԱŤ�˻������ʱ����ҽ�漴���˶�Ա�����˴�����Һ��D(�е�12.27��)����ֲ��䶳����������ԭ����___��
���𰸡�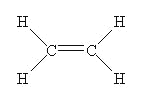 CH3CH3+Cl2
CH3CH3+Cl2![]() CH3CH2Cl+HCl �� ���ﵥһ���������� ���Ը��������Һ nCH2=CH2
CH3CH2Cl+HCl �� ���ﵥһ���������� ���Ը��������Һ nCH2=CH2![]()
![]() D�ķе�ϵͣ��ڳ��������ӷ�����Һ̬�����̬ʱ������������ʹ���˲�λ�ֲ��䶳������
D�ķе�ϵͣ��ڳ��������ӷ�����Һ̬�����̬ʱ������������ʹ���˲�λ�ֲ��䶳������
��������
��ϩ�IJ����Ǻ���һ������ʯ�ͻ�ѧ��ҵ�ķ�չˮƽ�ı�־�����л���AΪ��ϩ����ϩ��������һ�������·�Ӧ����B��BΪ���飻����D�ķ���ʽ��D����ͨ����ϩ��HCl�ӳɵõ���Ҳ����ͨ���������������ȡ����Ӧ�õ�����ϩ�ڴ����������¿��Ծ���ϩ������ϩ��һ�ֳ����ĸ߷��ӻ�����ݴ˷�����
��1�����ݷ������л���AΪ��ϩ����ṹʽΪ ��
��
��2����Ӧ��Ϊ�����������ȡ����Ӧ������ʽΪCH3CH3+Cl2![]() CH3CH2Cl+HCl��;���ڡ��۶����Եõ�D������;���۸�Ϊ������ԭ����;���۲��ﵥһ���������ɣ�
CH3CH2Cl+HCl��;���ڡ��۶����Եõ�D������;���۸�Ϊ������ԭ����;���۲��ﵥһ���������ɣ�
��3���л���AΪ��ϩ������̼̼˫�����л���BΪ���飬����̼̼˫������������ߵ��Լ����������Ը��������Һ����ϩ����ʹ���Ը��������Һ��ɫ��
��4����ϩ�ϳɾ���ϩ�ķ���ʽΪ��nCH2=CH2![]()
![]() ��
��
��5��D�ķе�ϵͣ��ڳ��������ӷ�����Һ̬�����̬ʱ������������ʹ���˲�λ�ֲ��䶳��������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ����ȼ�ϵ�طŵ�ʱ��ѧ��ȫ��ת��Ϊ����
B. ��Ӧ4Fe(s)+3O2(g)![]() 2Fe2O3(s)�����¿��Է��������÷�ӦΪ���ȷ�Ӧ
2Fe2O3(s)�����¿��Է��������÷�ӦΪ���ȷ�Ӧ
C. 3 mol H2��1 mol N2��Ϸ�Ӧ����NH3��ת�Ƶ��ӵ���ĿС��6��6.02��1023
D. ��ø������ˮ�ⷴӦ�����¶�Խ�ߵ���ˮ������Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������������˵������·�Ӧ�������������뻹ԭ�������ʵ���֮��Ϊ2��1���ǣ� ��
A. ![]()
B. Fe2O3+2Al![]() Al2O3+2Fe
Al2O3+2Fe
C. CaH2+2H2O===Ca��OH��2+2H2��
D. 3NO2+H2O===2HNO3+NO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaΪ�����ӵ�������ֵ����֪��Ӧ��
��CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) ��H1 =a kJ mol -1
��CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) ��H2 =bkJ mol-1
���ܶ��壺�ڱ�״���£���1 mol��̬����AB(g)����Ϊ��̬ԭ��
A(g)��B(g)�������������֪1 mol�����ļ���ΪxkJ�������������� ����ʾ������˵����ȷ����
��ѧ�� | C��O | C��H | O��H |
����/(kJ mol-1) | 798 | 413 | 463 |
A.������x=![]()
B.H2O(g) = H2O(1)����S<0����H=(a �� b) kJ mol -1
C.����4NA��O��H������ʱ����Ӧ�ų�������Ϊa kJ
D.���÷�Ӧ����Ƶ�ԭ��ص�⾫��ͭ�����������0.2NA������ʱ. �����ϵ��۵�������������6.4 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ�о���ѧϰС�������ʵ����֤Fe��Cu�Ľ�����ԣ�����������������ַ��������������������й�ʵ����Ŀ��
��1�������������������С��ȵ���Ƭ��ͭƬͬʱ����ϡ����(��ϡ����)�У��۲�������ݵĿ������ݴ�ȷ�����ǵĻ�ԡ���ԭ�������ӷ���ʽΪ___��
��2����������������Fe��Cu���缫��Ƴ�ԭ��أ���ȷ�����ǵĻ�ԡ���������ķ����ڻ���ԭ���װ��ͼ�����ԭ��صĵ缫���Ϻ͵������Һ����д�������ĵ缫��Ӧʽ___��

��3�������������ѧ��֪ʶ���������������һ����֤Fe��Cu��Եļ�ʵ�鷽��������(�뷽��������ͬ)��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������ֻ������Ե����̼�������缫���ϣ�������ZnSO4��Һ���л��߾�������̬����ʣ������ܷ�ӦΪMnO2+![]() Zn+(1+
Zn+(1+![]() ) H2O+
) H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]3��xH2O.���ؽṹ��ͼ1��ʾ��ͼ2���л��߾���ĽṹƬ�Ρ�����˵���У�����ȷ����
ZnSO4[Zn(OH)2]3��xH2O.���ؽṹ��ͼ1��ʾ��ͼ2���л��߾���ĽṹƬ�Ρ�����˵���У�����ȷ����

A.̼���ܾ��е����ԣ��������缫����
B.�ŵ�ʱ��Zn2+����MnO2Ĥ
C.���ʱ����ص�������ӦΪMnOOH- e- = MnO2 + H+
D.�ϳ��л��߾���ĵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Q�Ƕ�����ԭ�������������������Ԫ�ء�X���γɻ�������������Ԫ�أ�Y��Z�γɵĻ������������ɸ���Σ��.������0. 01 mol/L��W������������ˮ�������Һ��pH=12��QԪ���γɵĵ����ڳ������ǻ���ɫ���塣
��1��д��YԪ���γɵĵ��ʵĵ���ʽ: _______________ .
��2��Z��W��Q����Ԫ�طֱ��Ӧ�ļ����Ӱ뾶��С����___________(�����ӷ���)��
��3��QZ2��һ�ֳȻ�ɫ���ױ����壬������й©�ͱ�ը�¹ʣ��������뱬ը�ֳ�ʱ�����ý���һ��Ũ�ȵ�ij�����ʵ�ˮ��Һ��ë����ס���ӣ� �����˲��õ�������_______ (����ĸ����)��
A. NaOH B. NaCl C. KC1 D. Na2CO3
��4��X��Y��W����Ԫ�ؿ����γ�һ���о綾���Σ���QZ2���Գ�ȥˮ��Һ�к��еĸ��ж����ʣ��õ�һ�������г����Ĺ��������������. д���÷�Ӧ�����ӷ���ʽ:__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ϩʹ��ˮ��ɫ�ķ�Ӧ���ͺ�ʹ���Ը��������Һ��ɫ�ķ�Ӧ����____(������ͬ����������ͬ��)��
��2���ñ��Ʊ��屽�Ļ�ѧ����ʽ��____���÷�Ӧ������___��
��3����֪2CH3CHO��O2![]() 2CH3COOH��������ϩΪ��Ҫԭ�Ϻϳ����ᣬ��ϳ�·����ͼ��ʾ��
2CH3COOH��������ϩΪ��Ҫԭ�Ϻϳ����ᣬ��ϳ�·����ͼ��ʾ��
![]()
��Ӧ�ڵĻ�ѧ����ʽΪ___���÷�Ӧ������Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Ȼ�ѧ����ʽ��������ȷ���ǣ� ��
A.��֪C(ʯī��s)![]() C(���ʯ��s) ��H>0������ʯ��ʯī�ȶ�
C(���ʯ��s) ��H>0������ʯ��ʯī�ȶ�
B.��20.0gNaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7kJ����������÷�Ӧ���Ȼ�ѧ����ʽΪ��NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ��H=-57.4kJ/mol
C.���������������������ֱ���ȫȼ�գ����߷ų���������
D.N2(g)+3H2(g)![]() 2NH3(g)����H=-akJ��mol-1����14gN2(g)������H2����һ�ܱ������У���ַ�Ӧ��ų�0.5akJ������
2NH3(g)����H=-akJ��mol-1����14gN2(g)������H2����һ�ܱ������У���ַ�Ӧ��ų�0.5akJ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com