
| A. | 乙醇 | B. | 醋酸 | C. | 一氯甲烷 | D. | 三氯乙烯 |
科目:高中化学 来源: 题型:填空题
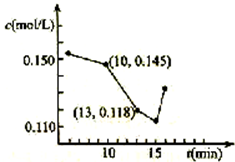 对低品位的菱镁矿(主要成份是MgCO3和CaCO3)的综合利用意义重大.矿石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应的化学方程式如下:
对低品位的菱镁矿(主要成份是MgCO3和CaCO3)的综合利用意义重大.矿石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应的化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的结构示意图: | |
| B. | 乙酸的结构示意图:C2H4O2 | |
| C. | 硫酸的电离方程式:H2SO4═H2++SO42- | |
| D. | 氯化钠的电子式: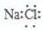 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电解法精炼铜时,粗铜作阴极、精铜作阳极 | |
| B. | 在镀件上电镀铜时,用金属铜作阳极 | |
| C. | 在电解池中,铜作电极时,溶液中的阴离子在铜极上失电子 | |
| D. | 电解饱和食盐水制稀硫酸制Cl2、H2时,可用金属铜作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
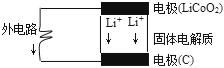 锂电池的构造如图所示,电池内部“→”表示放电时Li*的迁移方向,电池总反应可表示为:Li1-xCoO2+LixC$?_{放电}^{充电}$LiCoO2+6C,下列说法错误的是( )
锂电池的构造如图所示,电池内部“→”表示放电时Li*的迁移方向,电池总反应可表示为:Li1-xCoO2+LixC$?_{放电}^{充电}$LiCoO2+6C,下列说法错误的是( )| A. | 该电池的负极为LiCoO2 | |
| B. | 电池中的固体电解质可以是熔融的氯化钠、干冰等 | |
| C. | 充电时的阴极反应:Li1-xCoO2+xLi++xe-═LiCoO2 | |
| D. | 外电路上的“→”表示放电时的电子流向 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 $\stackrel{(1)O_{2}(2)Zn/H_{2}O}{→}$
$\stackrel{(1)O_{2}(2)Zn/H_{2}O}{→}$ +
+ (R1、R2、R3、R4为H或烷基)
(R1、R2、R3、R4为H或烷基)| A. | (CH3)2C=C(CH3)2 | B. |  | C. |  | D. | CH2=CH-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2 | B. | NO | C. | N2 O | D. | N2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
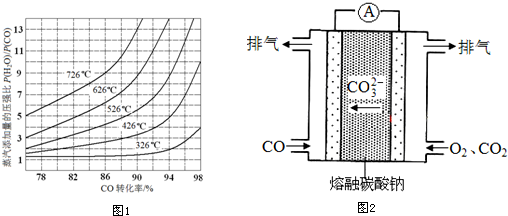
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
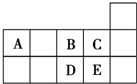
| A. | D在过量的B中燃烧的主要产物为DB3 | |
| B. | C的氢化物的水溶液酸性比E的强 | |
| C. | A与B形成的阴离子可能有AB32-、A2B42- | |
| D. | 原子半径:A>B>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com