
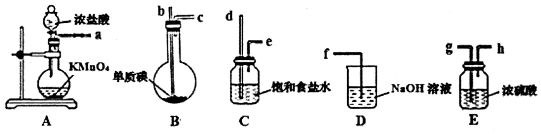
分析 (1)用干燥纯净的氯气与碘反应制备一氯化碘,A装置用高锰酸钾和浓盐酸制备氯气,制得的氯气中含有HCl气体和水蒸气,先用饱和食盐水(C)除HCl气体,再用浓硫酸(E)干燥,为充分除杂,导气管长进短出,将干燥的氯气通入B中与碘反应,制备ICl,而ICl挥发,所以B应放在冷水中,最后用氢氧化钠(D)处理未反应完的氯气,据此分析;
(2)单质碘和盐酸混合,控制温度约323K,边搅拌边滴加氯酸钠溶液,可制得一氯化碘,碘元素化合价升高,则氯酸钠中氯元素化合价降低,生成氯化钠;
(3)根据氧化性强的物质制氧化性弱的物质分析.
解答 解:(1)用干燥纯净的氯气与碘反应制备一氯化碘,A装置用高锰酸钾和浓盐酸制备氯气,制得的氯气中含有HCl气体和水蒸气,先用饱和食盐水(C)除HCl气体,再用浓硫酸(E)干燥,为充分除杂,导气管长进短出,将干燥的氯气通入B中与碘反应,制备ICl,而ICl挥发,所以B应放在冷水中,最后用氢氧化钠(D)处理未反应完的氯气,
①则装置顺序为adeghbcf;A中发生反应的离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
故答案为:deghbc; 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
②反应放热,ICl挥发,B放在冷水中,防止因反应放热使I2升华和ICl挥发;
故答案为:防止因反应放热使I2升华和ICl挥发;
③已知:一氯化碘沸点101℃,则B装置得到的液态产物进一步蒸馏或蒸馏,收集101℃的馏分可得到较纯净的ICl;
故答案为:蒸馏;
(2)单质碘和盐酸混合,控制温度约323K,边搅拌边滴加氯酸钠溶液,可制得一氯化碘,碘元素化合价升高,则氯酸钠中氯元素化合价降低,生成氯化钠,则反应物为:3I2+6HCl+NaClO3$\frac{\underline{\;323K\;}}{\;}$6ICl+NaCl+3H2O;
故答案为:3I2+6HCl+NaClO3$\frac{\underline{\;323K\;}}{\;}$6ICl+NaCl+3H2O;
(3)根据氧化性强的物质制氧化性弱的物质,可用湿润的KI淀粉试纸检验一氯化碘蒸气,试纸变蓝,则方法为:向足量KI饱和乙醇溶液中滴加1~2滴ICl的乙醇稀溶液,充分振荡,再滴加2~3滴淀粉溶液,若溶液变蓝,则证明ICl的氧化性强于I2;
故答案为:向足量KI饱和乙醇溶液中滴加1~2滴ICl的乙醇稀溶液,充分振荡,再滴加2~3滴淀粉溶液,若溶液变蓝,则证明ICl的氧化性强于I2.
点评 本题考查了物质的制备,涉及氧化还原反应、实验装置的选择、实验过程的控制,物质的分离提纯等知识点,为高考频点,题目难度中等,注意掌握物质性质灵活运用,善于提取题目的信息.


科目:高中化学 来源: 题型:选择题
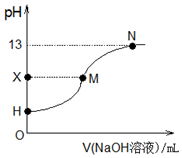
| A. | 酸碱滴定选用指示剂:甲基橙试液 | |
| B. | H点处的溶液:pH<3 | |
| C. | X=7时,M点对应加入氢氧化钠溶液的体积:25.00 mL | |
| D. | H、M、N三点各自对应的溶液:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
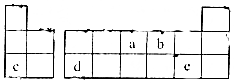
| A. | 气态氢化物的稳定性:a>b>c | |
| B. | 原子半径大小:a>b>c | |
| C. | c,d,e的氧化物对应的水化物之间两两皆能反应 | |
| D. | b、c形成的化合物中阴、阳离子的个数比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
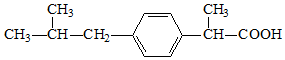
| A. | 布洛芬的分子式为C13H18O2 | |
| B. | 布洛芬与苯乙酸是同系物 | |
| C. | 1mol 布洛芬最多能与3mol 氢气发生加成反应 | |
| D. | 布洛芬在苯环上发生取代反应,其一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加酶洗衣粉洗衣服时水的温度越高越好 | |
| B. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关 | |
| C. | 小苏打是制作馒头的膨松剂,苏打是治疗胃酸过多的抗酸剂 | |
| D. | 乙醇、过氧化氢、次氯酸钠等消毒液的消毒原理都是利用其强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
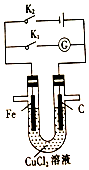
| A. | 同时打开K1、K2,铁棒上有紫红色物质析出 | |
| B. | 只闭合K1,石墨棒上有紫红色物质析出 | |
| C. | 只闭合K2,当电路中通过0.3mol电子时,两极共产生4.48L(标准状况)气体 | |
| D. | 只闭合K2,一段时间后,将电解质溶液搅拌均匀,溶液的pH变大(不考虑Cl2的溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16 g O2和O3 的混合气体中含有的分子数为0.5 NA | |
| B. | 25℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数日为1×10-5 NA | |
| C. | 标准状况下,2.24 L Cl2 通入足量H2O或NaOH溶液中转移的电子数均为0.1 NA | |
| D. | 常温下,1 mol的NaHCO3固体中含HCO3-的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
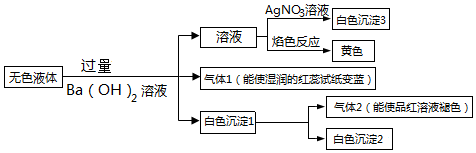
| A. | 气体2一定是SO2 | B. | 白色沉淀2一定是BaSO4 | ||
| C. | 白色沉淀1的成分只有2种可能 | D. | 溶液中只有HCO3-无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com