
����Ŀ�������£� 0.1 mol/L��ij��Ԫ�� H2A ��Һ�У����ܴ��ڵ����к� A ���ӵ����ʵ���������pH �仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A. H2A �ĵ��뷽��ʽ��H2A![]() H+ + HA��
H+ + HA��
B. pH = 5 ʱ����NaHA��Na2A�Ļ����Һ�У� c��HA���� : c��A2����= 1 : 100
C. �����ʵ���Ũ�ȵ�NaHA��Na2A��Һ�������ϣ�����Ũ�ȴ�С��ϵΪ��c��Na+����c��HA������c��A2����
D. NaHA��Һ�Լ���
���𰸡�B
��������
����Һ�к�A���ӵ����࣬��д��H2A�ĵ��뷽��ʽ���־���Һ���������غ�����ϵ���εĵ����ˮ������ι�ϵ�������Ƚ�����Ũ�ȡ�
A���ͼ��H2A ��Һ�к�A����ֻ��HA����A2�����֣������ǵ����ʵ�����������ҺpH�йء���H2A��ȫ����H2A��H+ + HA����HA������ȫ����HA��![]() H+ + A2����A�����
H+ + A2����A�����
B�ͼ�������߽������������ҺpH = 3 ʱ��c(HA��)��c(A2��)�����HA�����볣��Ki��![]() ��10��3����NaHA��Na2A�����Һ��pH = 5 ʱ��
��10��3����NaHA��Na2A�����Һ��pH = 5 ʱ��![]() ��10��3���� c��HA���� : c��A2����= 1 : 100��B����ȷ��
��10��3���� c��HA���� : c��A2����= 1 : 100��B����ȷ��
C���HA�����볣��Ki��10��3�������A2����ˮ�ⳣ��Kh��Kw/Ki��10��11����NaHA��Na2A�����ʵ���Ũ�ȵĻ����Һ�У�HA������̶ȴ���A2��ˮ��̶ȣ�c(HA��)<c(A2��)��C�����
D���HA������̶ȴ���A2��ˮ��̶ȣ���NaHA��Һ�����ԣ�D�����
����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��W��һ����Ч���Ե�Ѫ�����ż���һ�ֺϳ��������£�
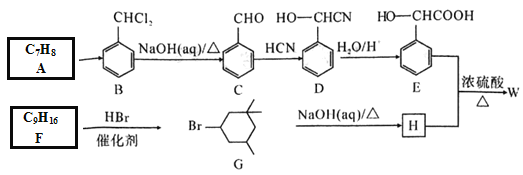
�ش���������
��1��E�к�̼�����ŵ�������_______��C��������_____��
��2��A��B��Ӧ�������Լ���___________��C��D�ķ�Ӧ������___________��
��3��д��W�Ľṹ��ʽ��___________���ܲⶨH������������ѧ�����������������������____________��
��4��д��F��G�Ļ�ѧ����ʽ��__________��
��5��R��E��ͬ���칹��Rͬʱ�߱����������Ľṹ��______��
�����Ȼ�����Һ������ɫ��Ӧ�� ���ܷ���ˮ�ⷴӦ��������Ӧ�����У��ں˴Ź�����������5����ҷ�������Ϊ1��1��2��2��2�Ľṹ��ʽΪ___________��
��6������ȩΪԭ�Ϻϳɻ��� ����ƺϳ�·�ߣ������Լ���ѡ����______________��
����ƺϳ�·�ߣ������Լ���ѡ����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں�����ߺ�DZˮͧ�п��ù���������Ϊ����������ѡ���ʵ��Ļ�ѧ�Լ���ʵ����Ʒ������ͼ�е�ʵ��װ�ý���ʵ�飬֤���������ƿ�����������

��1��A����ȡCO2��װ�ã�д��A�з�����Ӧ�Ļ�ѧ����ʽ___________________��
��2����д���пո�
���� | �����Լ� | ������Լ���Ŀ�� |
B | ����NaHCO3��Һ | ��ȥ������̼�е��Ȼ��� |
C | ____________ | ____________ |
D | NaOH��Һ | ____________ |
��3��д��C�з�����Ӧ�Ļ�ѧ����ʽ��___________________��
��4���Թ�F���ռ����������һ��ʵ������ǰ�E�еĵ����Ƴ�ˮ�棬�رշ�Һ©����������Ĵָ��ס�Թܿڣ�ȡ���Թܣ�������_____________________����֤���Թ����ռ���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ö��Ե缫�������������Һһ��ʱ����ټ���һ���������ڵĴ������ʹ��Һ�ָ���ԭ���ijɷֺ�Ũ�ȵ���
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
���𰸡�D
��������ʯī�缫Ϊ���Ե缫����Һ���������������ŵ磬�������������ŵ���A�����AgNO3��Һ��Ag+�������ŵ�����Ag��OH-�������ŵ�����O2����n(Ag)��n(O2)=2��1,��Ӧ����Ag2O�ָ�Ũ�ȣ���A����B�����NaOH��Һ��H+�������ŵ�����H2��OH-�������ŵ�����O2����n(H2)��n(O2)=2��1,��Ӧ����һ������H2O�ָ�ԭ������B������C�����KCl��Һ��H+�������ŵ�����H2��Cl-�������ŵ�����Cl2����n(H2)��n(Cl2)=1��1,��Ӧ����һ����HCl�ָ�ԭ������C����D�����CuSO4��Һ��Cu2+�������ŵ�����Cu��OH-�������ŵ�����O2����n(Cu)��n(O2)=2��1,��Ӧ����һ����CuO�ָ�ԭ������D��ȷ����ѡD��
�㾦��������ⷴӦ��ԭ��������������ʲô��������������������൱��ʲô�������뷴Ӧ��ϵ������Ԫ���غ��ԭ�ӱ����������Ӧ�����ʣ�����ʹ��Һ��ȫ��ԭ��
�����͡���ѡ��
��������
28
����Ŀ����ҵ���õ�ⷨ�����������Է�ˮ���õ�����Ni��ԭ����ͼ��ʾ������˵������ȷ����

��֪����Ni2������������Һ�з���ˮ��
�������ԣ�Ni2��(��Ũ��)>H��>Ni2��(��Ũ��)
A. ̼���Ϸ����ĵ缫��Ӧ��4OH����4e��=O2����2H2O
B. �������У�B��NaCl��Һ�����ʵ���Ũ�Ƚ����ϼ���
C. Ϊ�����Ni�IJ��ʣ�����������Ҫ���Ʒ�ˮpH
D. ����ͼ��������Ĥȥ������A��B���Һϲ������ⷴӦ�ܷ���ʽ�����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ں�ˮ��CO2��Ҫ��4����̼��ʽ���ڣ����� HCO3��ռ95 % ������ͼʾװ�ôӺ�ˮ����ȡCO2�������ڼ��ٻ����������庬��������˵����ȷ����
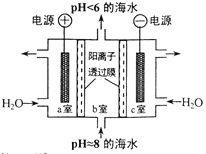
A. a ���ų�����NaOH ��Ca��OH��2��ǿ��������
B. b �ҷ�����Ҫ��Ӧ�� 2H��+ CO32��=== H2O +CO2��
C. c�ҷ����ķ�ӦΪ 2H2O��4e��===O2���� 4H+
D. װ���в����� O2����ȡ�� CO2�������ԼΪ1��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥKCl��Һ��������MgCl2��MgSO4���ʣ���ѡ��Ba(OH)2��Һ��ϡ�����K2CO3��Һ�����Լ�������ͼ���������
![]()
��1��д�������Լ��Ļ�ѧʽ��A____��B____��C____
��2���������������____��
��3���������⣬�ش��������⣺
�ټ������A��Ŀ����____��
�ڼ�������C��Ŀ����_____��
�ۼ���Bʱ�Ļ�ѧ��Ӧ����ʽ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���A��B��0��32mol����10L�����ܱ������У�������Ӧ��
A(g)+B(g)![]() 2C(g) ��H<0����Ӧ�����вⶨ���������±�������˵����ȷ����
2C(g) ��H<0����Ӧ�����вⶨ���������±�������˵����ȷ����
t��min | 0 | 2 | 4 | 7 | 9 |
n(B)��mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
A. ��Ӧǰ2 min��ƽ������v(C)=0��004 mol��(L��min)
B. �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv (��)> v (��)
C. �����������䣬��ʼʱ�������г���0��64mol A��0��64mol B��ƽ��ʱn(C)<0��48mol
D. �����������䣬��ƽ����ϵ���ٳ���0��32mol A���ٴ�ƽ��ʱ��B��ת��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����200 mL��Mg2����Al3����NH4����H����Cl�������ӵ���Һ�У���μ���5molL��1������������Һ����������������Һ�����(mL)��������������ʵ���(mol)��ϵ��ͼ��ʾ������������ȷ���ǣ� ��

A.x��y�IJ�ֵΪ0.02mol
B.ԭ��Һ��c(Cl��)��0.75mol��L��1
C.ԭ��Һ��pH��1
D.ԭ��Һ��n(Mg2��)��n(Al3��)��5��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭ��Ӧ�У�ˮ��Ϊ���������ǣ� ��
A. CO+H2O![]() CO2+H2B. CuO+H2
CO2+H2B. CuO+H2![]() Cu+H2O
Cu+H2O
C. 2F2+2H2O�T4HF+O2D. 3NO2+H2O�T2HNO3+NO
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com