
分析 (1)Cu、Zn和稀硫酸构成原电池时,Zn作负极、Cu作正极,稀硫酸作电解质溶液;
(2)该装置构成原电池后,Zn失电子而溶解、Cu上氢离子得电子生成氢气;
(3)如果锌片不纯,则锌片和杂质构成微型原电池;
(4)锌易失电子作负极、铜作正极,正极上氢离子得电子生成氢气;
(5)原电池工作一段时间后,锌质量减少3.25g,根据锌和转移电子之间的关系式计算.
解答 解:(1)Cu、Zn和稀硫酸构成原电池时,Zn作负极、Cu作正极,稀硫酸作电解质溶液,其装置图为 ,故答案为:
,故答案为: ;
;
(2)该装置构成原电池后,Zn失电子而溶解、Cu上氢离子得电子生成氢气,所以看到的现象是铜片上有大量气泡,锌片上无气泡,锌片不断溶解,故答案为:铜片上有大量气泡,锌片上无气泡,锌片不断溶解;
(3)如果锌片不纯,则锌片和杂质构成微型原电池,所以锌片上有少量氢气生成,故答案为:锌片不纯,与所含杂质可以形成许多微型原电池;
(4)锌易失电子作负极、铜作正极,正极上氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,故答案为:Zn;2H++2e-=H2↑;
(5)原电池工作一段时间后,锌质量减少3.25g,根据锌和转移电子之间的关系式得转移电子物质的量=$\frac{3.25g}{65g/mol}×2$=0.1mol,故答案为:0.1.
点评 本题考查原电池设计,为高频考点,明确原电池原理是解本题关键,会根据发生的反应、电极特点确定正负极,题目难度不大.


科目:高中化学 来源: 题型:解答题
 如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.
如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度和体积都相同的盐酸和醋酸溶液,在与足量锌反应时,起始时二者产生H2速率基本相等 | |
| B. | 100mL1mol•L-1的盐酸和50mL2mol•L-1的盐酸,分别与足量的锌反应时,两者放出H2速率和质量均相等 | |
| C. | 100mLpH=3的H2SO4和HCl溶液,与足量锌反应后,放出H2的质量相等 | |
| D. | 100mLpH=3的盐酸与醋酸溶液,与足量锌反应后,所得H2的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同样多 | B. | HCl最多 | C. | 醋酸最多 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
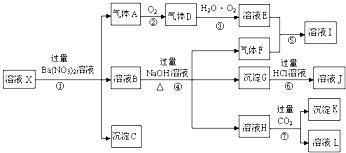
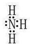 ,实验中,可以观察到反应②的现象是:气体由无色变成红棕色.
,实验中,可以观察到反应②的现象是:气体由无色变成红棕色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,Ksp(CaCO3)=2.8×10-9 | |
| B. | 加入Na2CO3溶液的过程中,先生成CaCO3沉淀 | |
| C. | 滤液M中c(Cl-)>c(Na+)>c(Mg2+)>c(CO32-)>c(OH-) | |
| D. | 滤液M中$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$=$\frac{{K}_{sp}(CaC{O}_{3})}{{K}_{sp}(MgC{O}_{3})}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com