
| A. | 只有②③ | B. | ①④⑤ | C. | ②③④ | D. | 只有①④ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①混合气体平均相对分子质量不变,说明气体的质量不变,反应达平衡状态,故正确;
②气体两边计量数相等,容器内气体压强始终不变,故错误;
③气体两边计量数相等,混合气体总物质的量始终不变,故错误;
④C物质的量浓度,说明正逆反应速率相等,达平衡状态,故正确;
⑤混合气体的颜色不再变化,说明D的浓度不变,反应达平衡状态,故正确;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
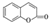 )是一种应用广泛的香料和药物中间体.以甲苯为原料生产香豆素流程如下:
)是一种应用广泛的香料和药物中间体.以甲苯为原料生产香豆素流程如下: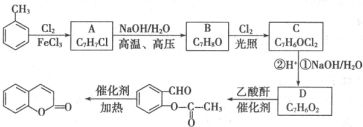
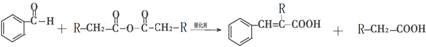
 ,D的结构简式是
,D的结构简式是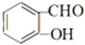 .
.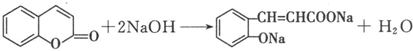 .
. .
.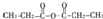 ,通过反应Ⅰ和反应Ⅱ,得到芳香化合物E,E的结构简式是
,通过反应Ⅰ和反应Ⅱ,得到芳香化合物E,E的结构简式是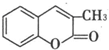 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -44.2kJ/mol | B. | +44.2kJ/mol | C. | -330kJ/mol | D. | +330kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  配制一定物质的量浓度的硫酸溶液 配制一定物质的量浓度的硫酸溶液 | B. |  检验装置的气密性 检验装置的气密性 | ||
| C. |  从碘水中分离碘单质 从碘水中分离碘单质 | D. |  探究碳酸氢钠的热稳定性 探究碳酸氢钠的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 调节体温 | B. | 帮助消化 | C. | 排泄废物 | D. | 提供能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com