
【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),
如图所示。导致该现象的主要原因是液滴下面的氧气
含量比液滴边缘少。下列说法正确的是

A.(a)区腐蚀比(b)区腐蚀严重
B.该过程发生了化学反应:4Fe+3O2=2Fe2O3
C.该过程是析氢腐蚀,负极反应为:Fe-2e- =Fe2+
D.该过程为吸氧腐蚀,正极反应为:O2+2H2O+4e-=4OH-
【答案】D
【解析】
该条件下,铁发生吸氧腐蚀,Fe易失电子作负极、C作正极,负极反应式为Fe-2e- =Fe2+,正极反应式O2+2H2O+4e-=4OH-,Fe2++2OH-=Fe(OH)2、4 Fe(OH)2+O2+2H2O= Fe(OH)3,Fe(OH)3失水生成带结晶水的氧化铁,即生成铁锈,
A.氧气含量越高铁腐蚀越严重,a区氧气含量小于b区,所以b区腐蚀严重,选项A错误;
B.该过程发生了化学反应:4Fe+3O2+6H2O=4 Fe(OH)3,选项B错误;
C.中性条件下发生吸氧腐蚀,选项C错误;
D.中性条件下发生吸氧腐蚀,正极反应式为O2+2H2O+4e-=4OH-,选项D正确;
答案选D。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】结晶玫瑰广泛用于香料中,它的两条合成路线如下图所示:

已知:两个羟基同时连在同一碳原子上的结构不稳定,会发生脱水反应:
![]() +H2O
+H2O
完成下列填空:
(1)A的俗称是_________;D中官能团的名称是_______;反应②的反应类型是_______。
(2)写出G与氢氧化钠溶液反应的化学方程式__________。
(3)已知: ,则可推知反应②发生时,会得到一种副产物,写出该副产物的结构简式_____。
,则可推知反应②发生时,会得到一种副产物,写出该副产物的结构简式_____。
(4)G的同分异构体L遇FeCl3溶液显色,与足量浓溴水反应未见白色沉淀产生,若L与NaOH的乙醇溶液共热能反应,则共热生成的有机物的结构简式为________________(任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.石灰水中加入过量小苏打溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
B.用石墨作电极电解AlCl3溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O
D.0.2mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、硅及其化合物用途非常广泛。回答下列问题:
(1)基态Si原子价层电子的电子排布式为___,基态Mg原子电子占据最高能级的能层符号___。
(2)Mg2C3与CaC2的结构相似,与水反应可生成H2C=C=CH2,H2C=C=CH2端位碳原子的杂化方式是__,该反应所涉及的元素中电负性最小的是__(填元素符号),Mg2C3和H2C=C=CH2中均不存在___(填字母)。
A.σ键 B.配位键 C.氢键 D.π键
(3)晶格能又叫点阵能。它是1mol离子化合物中的正、负离子从相互分离的气态结合成离子晶体时所放出的能量。MgO晶格能可通过图1的BornHaber循环计算得到。
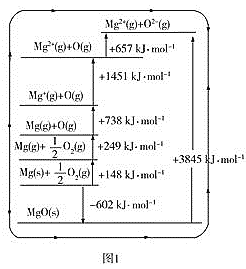
MgO的晶格能为___kJ·mol-1,O=O键的键能为__kJ·mol-1;Mg的第一电离能为___kJ·mol-1;
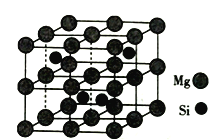
(4)Mg2Si晶胞结构如图2所示,已知其密度为1.84g·cm3,NA为阿伏加德罗常数的值。则晶胞参数a=__nm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,完成下面小题。
随着社会经济的发展,汽车已进入千家万户,它给人们出行带来方便的同时汽车尾气污染问题也日益突显,汽车尾气中含NO、NO2、CO2、SO2和固体悬浮颗粒等。用活性炭还原处理氮氧化物是一种实用的氮氧化物转化方法:C(s)+2NO(g) ![]() N2(g)+CO2(g),可实现氮氧化物无害转化。
N2(g)+CO2(g),可实现氮氧化物无害转化。
【1】下列环境问题与汽车尾气的大量排放无关的是
A.酸雨B.温室效应C.PM2.5超标D.白色污染
【2】该反应属于化学基本反应类型中的
A.化合反应B.分解反应C.置换反应D.复分解反应
【3】该反应属于氧化还原反应,下列说法正确是
A.C元素被还原B.NO得到电子C.NO发生氧化反应D.CO2是氧化剂
【4】关于该反应下列说法不正确的是
A.升高温度能够加快反应速率
B.降低NO浓度能够减慢反应速率
C.使用合适的催化剂可以加快反应速率
D.加入足量的炭粉可以使NO 100%转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( )
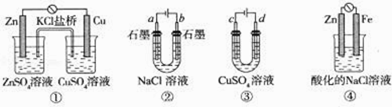
A. 装置①中,盐桥中的K+移向ZnSO4溶液
B. 滴有酚酞溶液的装置②在电解过程中,b极先变红
C. 可以用装置③在铁上镀铜,d极为铜
D. 装置④中发生铁的吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组的同学在学习NH3的性质时讨论:既然NH3具有还原性,能否像H2那样还原CuO呢?于是他们设计了如下实验装置(夹持装置未画出)进行实验。

请回答下列问题:
(1)仪器a的名称为______________;仪器b中可选择的试剂为______________;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,干燥管D增重,量气管内收集到无色无味的单质气体,上述现象可以证明NH3具有________性,写出相应的化学方程式_____________;
(3)E装置中浓硫酸的作用是________________________________
(4)读取气体体积前,应对装置F进行的操作是:________________________若读数时,量气管中的液面低于水准管的液面,则量气管中气体的体积将_____。(填“偏大”、“偏小”或“不变”)。
(5)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+→Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O:_______________________________。
(6)此套实验装置还可用于测定氨气的分子组成。若实验完毕,测得干燥管D增重m克,装置F测得气体的体积为n升(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
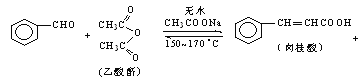 CH3COOH
CH3COOH
药品物理常数
苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
沸点(℃) | 179.6 | 138.6 | 300 | 118 |
填空:
合成:反应装置如图所示.向三颈烧瓶中先后加入研细的无水醋酸钠、苯甲醛和乙酸酐,振荡使之混合均匀. 在150~170℃加热1小时,保持微沸状态.
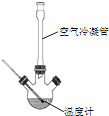
(1)空气冷凝管的作用是__.
(2)该装置的加热方法是__.加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是______.
(3)不能用醋酸钠晶体(CH3COONa3H2O)的原因是______.
粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:
反应混合物![]()
![]()
![]()
![]()
![]() 肉桂酸晶体
肉桂酸晶体
(4)加饱和Na2CO3溶液除了转化醋酸,主要目的是_______.
(5)操作I是__;若所得肉桂酸晶体中仍然有杂质,欲提高纯度可以进行的操作是__(均填操作名称).
(6)设计实验方案检验产品中是否含有苯甲醛_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示
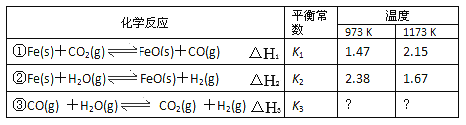
下列说法正确的悬
A. △H1<0,△H2>0
B. 反应①②③的反应热满足关系:△H2-△H1=△H3
C. 反应①②③的平衡常数满足关系;K1·K2=K3
D. 要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com