
下列不能形成配位键的组合是( )
|
| A. | Ag+、NH3 | B. | BF3、NH3 | C. | NH4+、H+ | D. | Co3+、CO |
考点:
配合物的成键情况.
分析:
根据形成配位键的条件,一方提供孤电子对,一方提供空轨道,可以作判断.
解答:
解:根据配位键形成的条件,一方要提供空轨道,另一方提供孤电子对,
A、Ag+有空轨道,NH3中的氮原子上的孤电子对,可以形成配位键,故A不选;
B、BF3中B原子有空轨道,NH3中的氮原子上的孤电子对,可以形成配位键,故B不选;
C、NH4+、H+两种离子均没有孤电子对,所以不能形成配位键,故C选;
D、Co3+有空轨道,与CO中的氧原子上的孤电子对,可以形成配位键,故D不选;
故选C.
点评:
本题主要考查配位键形成的条件,难度较小,解题时要注意弄清楚各种原子或离子的最外层电子对的情况.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现血红色.
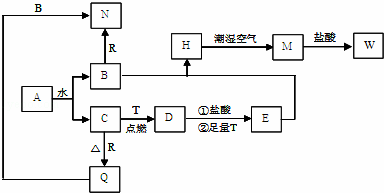
(1)写出下列物质的化学式:D: E: N: .
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象: ;
(3)按要求写方程式:
B和R反应生成N的离子方程式: ;
M→W的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是(NA表示阿伏加德罗常数)()
A. 常温常压下,22.0 gCO2所含的电子数为22NA
B. 常温常压下,1mol氦气含有原子数为NA
C. 0.5mol•L﹣1 Na2CO3溶液中含有Na+离子的数目为NA
D. 标准状况下,22.4LCCl4含有的氯原子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数
据回答下列问题:
(1)该盐酸中HCl的物质的量浓度为 mol•L﹣1
(2)某同学用上述浓盐酸和蒸馏水配制浓度为0.4mol•L﹣1体积为425mL的稀盐酸.
①该学生需要取 mL上述浓盐酸进行配制.
②配制过程中,所用到的仪器除烧杯、玻璃棒、量筒外还需 、 .
③上述实验中,需要用到玻璃棒,其作用是 、 .
④在配制过程中,下列操作对配制的稀盐酸的物质的量浓度有何影响(填“偏 大”、“偏小”或“无影响”)
Ⅰ.用量筒量取浓盐酸时俯视观察凹液面
Ⅱ.定容时仰视刻度线 .

查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组原子中,彼此化学性质一定相似的是( )
|
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 |
|
| B. | 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 |
|
| C. | 2p轨道上有三个未成对的电子的X原子与3p轨道上有三个未成对的电子的Y原子 |
|
| D. | 最外层都只有一个电子的X、Y原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
|
| A. | N2分子有一个δ键,两个π键 |
|
| B. | δ键比π键重叠程度大,形成的共价键一定强 |
|
| C. | 两个原子间形成共价键时,最多有一个δ键 |
|
| D. | 气体单质中,一定有δ键,可能有π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在HF、H2S、NH3、BF3、CCl4、N2、SO2分子中:
(1)以非极性键结合的非极性分子是
(2)以极性键相结合,具有平面正三角形结构的非极性分子是
(3)以极性键相结合,具有正四面体结构的非极性分子是
(4)以极性键相结合,具有三角锥型结构的极性分子是
(5)以极性键相结合,具有V型结构的极性分子是
(6)以极性键相结合,而且分子极性最大的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家研制出以锶原子为钟摆的“晶格钟”成为世界上最精准的钟.锶元素在元素周期表中的信息与锶原子结构示意图如图所示,下列说法错误的是( )
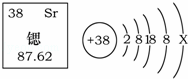
|
| A. | Sr为金属元素 | B. | 乙图中X=2 |
|
| C. | 锶原子的质量为87.62g | D. | 锶原子的质子数是38 |
查看答案和解析>>
科目:高中化学 来源: 题型:
物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体.下列关于物质X的说法正确的是()
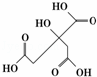
A. X分子式为C6H7O7
B. 1 mol物质X可以和3 mol氢气发生加成
C. 足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体物质的量相同
D. X分子内所有原子均在同一平面内
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com