
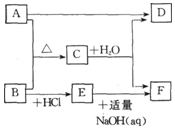
 A、B、C、D、E、F是中学化学中的常见物质,它们之间的转化关系如图所示.其中 A、B为单质,F为白色沉淀,D为气体.
A、B、C、D、E、F是中学化学中的常见物质,它们之间的转化关系如图所示.其中 A、B为单质,F为白色沉淀,D为气体.分析 A、B为单质,A与B反应生成的C发生水解得F为白色沉淀,D为气体,可推知,D应为氢氧化物,F为氢氧化物,
(1)若D的水溶液显弱酸性,则D应为H2S,由于B能与盐酸反应生成E,E又能与氢氧化钠反应生成F,则B应为铝,所以A为硫,生成的C为硫化铝,铝与盐酸反应生成E为氯化铝,氯化铝与适量的氢氧化钠反应生成F为氢氧化铝,硫化铝水解得硫化氢气体和氢氧化铝,;
(2)若D的水溶液显弱碱性,则D应为NH3,由于B能与盐酸反应生成E,E又能与氢氧化钠反应生成F,则B应为Mg,所以A为氮气,生成的C为Mg3N2,Mg与盐酸反应生成E为氯化镁,氯化镁与适量的氢氧化钠反应生成F为氢氧化镁,氮化镁水解得氨气和氢氧化镁,以此解答该题.
解答 解:A、B为单质,A与B反应生成的C发生水解得F为白色沉淀,D为气体,可推知,D应为氢氧化物,F为氢氧化物,
(1)若D的水溶液显弱酸性,则D应为H2S,由于B能与盐酸反应生成E,E又能与氢氧化钠反应生成F,则B应为Al,所以A为S,生成的C为硫化铝,铝与盐酸反应生成E为氯化铝,氯化铝与适量的氢氧化钠反应生成F为氢氧化铝,硫化铝水解得硫化氢气体和氢氧化铝,
故答案为:S;Al; A12S3;H2S;AlCl3;Al(OH)3;
(2)若D的水溶液显弱碱性,则D应为NH3,由于B能与盐酸反应生成E,E又能与氢氧化钠反应生成F,则B应为Mg,所以A为氮气,生成的C为Mg3N2,Mg与盐酸反应生成E为氯化镁,氯化镁与适量的氢氧化钠反应生成F为氢氧化镁,氮化镁水解得氨气和氢氧化镁,
故答案为:N2;Mg;Mg3N2;NH3;MgCl2;Mg(OH)2.
点评 本题考查无机物的推断,为高频考点,解答本题时注意根据D和F的性质及转化关系等信息为突破口,注意把握相关物质的性质,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 升高温度能使化学反应速率增大,主要原因是增加了活化分子的百分数,从而使有效碰撞频率提高 | |
| B. | 增大气体反应的压强,单位体积中活化分子数增多,气体反应速率加快 | |
| C. | 增大反应物的浓度,活化分子百分数增加,反应速率加快 | |
| D. | 催化剂通过改变反应路径,使反应所需的活化能降低,反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=0.1mol•L-1的溶液:Na+、NH4+、SO42-、S2O32- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ | |
| C. | 在由水电离出的c(H+)=1×10-12mol•L-1的溶液:Fe3+、ClO-、Na+、SO42- | |
| D. | c(Fe3+)=0.1mol•L-1的溶液:H+、Al3+、Cl-、SCN- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com