
| A. | NH3极易溶于水,可用于工业制冷剂 | |
| B. | 木炭具有还原性,可用于冰箱和居室除臭剂 | |
| C. | Al2O3是两性氧化物,可用于制造高温材料 | |
| D. | Na、K合金熔点低且导热,可用于快中子反应堆的导热剂 |
分析 A.氨气用于工业制冷与液氨吸热有关;
B.用于冰箱和居室除臭剂与吸附性有关;
C.氧化铝的熔点较高;
D.Na、K合金具有良好的导热性.
解答 解:A.氨气化时吸收热量导致其周围环境温度降低,所以液氨可以作制冷剂,与氨气的溶解性大小无关,故A错误;
B.用于冰箱和居室除臭剂与吸附性有关,与木炭的还原性无关,故B错误;
C.氧化铝的熔点较高,可用于制造耐高温材料,与两性的性质无关,故C错误;
D.Na、K合金具有良好的导热性,且熔点低,可用于快中子反应堆的导热剂,故D正确.
故选D.
点评 本题考查较为综合,涉及物质的性质、环保等知识,为高考常见题型和高频考点,侧重化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 达到平衡时A的总转化率为40% | B. | 达到平衡时c(B)为1.0mol•L-1 | ||
| C. | 达到平衡时c(B)=2c(D) | D. | 达到平衡时c(D)为0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(B)mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 前50s内B的平均反应速率v(B)=0.0032mol•L-1•s-1 | |
| B. | 相同温度下,若达平衡后向容器中继续充入A,则平衡向右移动,平衡常数增大 | |
| C. | 相同温度下,若起始时向容器中充入1.0mol A、0.20mol B和0.20mol C,则达到平衡前 v(正)>V(逆) | |
| D. | 若保持其他条件不变,升高温度,平衡时,平衡常数K=0.2mol.L-1,则反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2的燃烧热为285.8 kJ•mol-1,则表示H2燃烧的热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 中和热为57.3 kJ•mol-1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知:C(s,金刚石)+O2(g)═CO2(g)△H=-395.4 kJ•mol-1,C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1,则C(s,金刚石)═C(s,石墨)△H=-1.9 kJ•mol-1 | |
| D. | 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
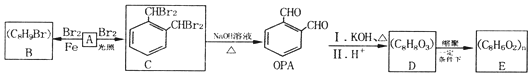
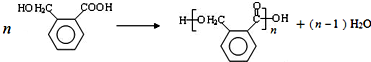 .
.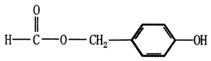 (填结构简式).
(填结构简式).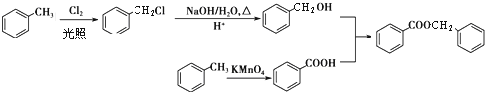 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨可用作制冷剂是因为其气化时可放出大量的热 | |
| B. | 将青蒿在乙醚中浸取,通过分馏可提取治疗疟疾的青蒿素 | |
| C. | 钢制品、铝制品在日常生活中被广泛应用是因为铁、铝为活泼金属 | |
| D. | 久置的漂白粉变质是因为漂白粉与空气中的O2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,46 gNO2与N2O4的混合气体中含有的分子总数为NA | |
| B. | 常温常压下,将0.1molFe投人足量的浓硝酸中,转移的电子数为0.3NA | |
| C. | 25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA | |
| D. | 0.1mol乙烯和乙醇的混合物完全燃烧所消耗O2的分子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
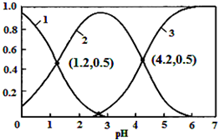 已知H2SO3?HSO3-+H+,Ka1;HSO3-?SO32-+H+,Ka2.常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
已知H2SO3?HSO3-+H+,Ka1;HSO3-?SO32-+H+,Ka2.常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )| A. | pH=1.2溶液中:c(Na+)+c(H+)═c(OH-)+c(H2SO3) | |
| B. | 常温下,$\frac{{c}^{2}(HS{{O}_{3}}^{-})}{c({H}_{2}S{O}_{3})•c(S{{O}_{3}}^{2-})}$=1000 | |
| C. | 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度先增大后减小 | |
| D. | 曲线3表示的微粒是SO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com