
分析 电解溴化钾溶液生成氢氧化钾和氢气、溴单质;溴单质与二氧化硫、水反应生成硫酸和氢溴酸;
依据原子个数守恒结合原子个数守恒计算生成溴单质的物质的量,依据SO2+Br2+2H2O=H2SO4+2HBr计算二氧化硫的物质的量,据此解答.
解答 解:电解溴化钾溶液生成氢氧化钾和氢气、溴单质,化学方程式:2KBr+2H2O$\frac{\underline{\;电解\;}}{\;}$2KOH+H2↑+Br2;溴单质与二氧化硫、水反应生成硫酸和氢溴酸,化学方程式:SO2+Br2+2H2O═H2SO4+2HBr;
设每分钟电解KBr溶液生成Br2的物质的量为x,
则:2Br-Br2 电子转移
1 mol 2 mol
x 8.56×10-11×60 mol
解得:x=2.568×10-9mol,
根据SO2+Br2+2H2O=H2SO4+2HBr可知SO2的物质的量为2.568×10-9mol,
所以空气中SO2的含量为:$\frac{2.568×1{0}^{-9}×64}{1.5×1{0}^{-4}}$g•m-3=1.1×10 -3gm-3,
答:主要的化学反应方程式为2KBr+2H2O$\frac{\underline{\;电解\;}}{\;}$2KOH+H2↑+Br2、SO2+Br2+2H2O═H2SO4+2HBr;该地区空气中SO2的含量为1.1×10 -3gm-3.
点评 本题考查了化学方程式的书写与计算,题目难度中等,明确实验目的及实验原理为解答关键,注意熟练掌握化学方程式的书写原则,试题培养了学生的分析能力及化学计算能力.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题
 在实验室里,第一位同学取一小块金属钠做与水反应的实验.试完成下列问题:
在实验室里,第一位同学取一小块金属钠做与水反应的实验.试完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 配料 | 精盐、碘酸钾(KIO3)、抗结剂 |
| 碘含量 | 35±15mg/kg |
| 储存方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
| A. | 高温会导致碘的损失 | B. | 碘酸钾可氧化氯化钠 | ||
| C. | 可用淀粉检验碘盐中的碘酸钾 | D. | 该碘盐中碘含量是指碘酸钾的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
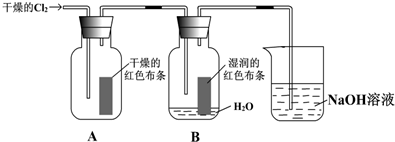
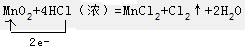
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150ml 1mol/L氯化钠溶液 | B. | 150ml 3mol/L氯化钾溶液 | ||
| C. | 75ml 2mol/L氯化铵溶液 | D. | 50ml 1mol/L氯化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
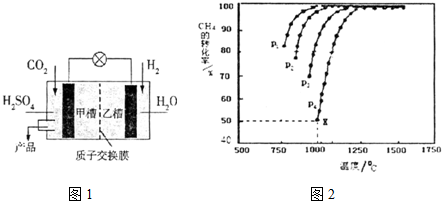 第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减 少温室气体排放量.
第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减 少温室气体排放量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1mol•L-1NaCl溶液 | B. | 75mL 1mol•L-1 CaCl2溶液 | ||
| C. | 150mL 1mol•L-1 KCl溶液 | D. | 75mL 1mol•L-1 AlCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com