
����Ŀ��Ϊ�˼������ˮ��IJ���������ʵ�鷽����
![]()
��ش��������⣺
��1���Լ�1Ϊ20%��H2SO4��Һ����������_________��
��2���Լ�2Ϊ_________����������_________��ʹ����ˮ������ʵ�����˳�����У�������Ӧ�����ӷ���ʽΪ��_________��
��3����Ӧ�ٵĻ�ѧ����ʽΪ_________��
��4��Ϊ�������Һ�Ƿ�����ȫˮ�⣬ȡ����ˮ��Һ���Թ��У������ˮ����֤������δ��ȫˮ���������_________��
��5�����ʵ�������û�м����Լ�2��ֱ�Ӽ�������������ͭ����Һ���ܷ�ʵ��ʵ��Ŀ��_________���������������������������ܣ���ԭ����_________����ĸ�����ʩ��_________��
���𰸡������� ����������Һ �к������������� H++OH��=H2O ��C6H10O5��n+nH2O![]() nC6H12O6 ����ɫ �� �������ܽ�Cu��OH��2��ʹʵ��ʧ�� ֱ������Һ�м����Թ�����NaOH��Һ
nC6H12O6 ����ɫ �� �������ܽ�Cu��OH��2��ʹʵ��ʧ�� ֱ������Һ�м����Թ�����NaOH��Һ
��������
��1�����۵�ˮ����̣��������ϡ�������������ӿ���۵�ˮ�ⷴӦ���ʣ�
��2��������������������ͭ����Һ������Ӧ��Ҫ��Ϊ���ԣ�ϡ�����ܹ���������ͭ��Ӧ���ᵼ��ʵ��ʧ�ܣ�Ӧ���ȼ�������������Һ�к�ϡ���ᣬ��Ӧ�����ӷ���ʽΪ��H++OH��=H2O��
��3��������ϡ������������ȫˮ�����������ǣ�ˮ�ⷽ��ʽΪ��
��C6H10O5��n+nH2O![]() nC6H12O6
nC6H12O6
���� ������
��4���������ⵥ����ʾ��ɫ���ݴ˿��Լ�������Ƿ���ȫˮ�⣬����Ϊ��ȡ����ˮ��Һ���Թ��У������ˮ�������Һ����ɫ����֤������δ��ȫˮ�⣻
��5��������������������кʹ���ϡ���ᣬ�����������ܽ�Cu��OH��2��ʹʵ��ʧ�ܣ����ﵽʵ��Ŀ�ģ�Ϊ�˱���ʵ��ʧ�ܣ�Ӧ��ֱ������Һ�м����Թ�����NaOH��Һ�к�ϡ���ᡣ



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A.0.01molL-1KAl(SO4)2��Һ�е�SO42-��ĿΪ0.02NA
B.��Ũ����ֱ���MnO2��KClO3��Ӧ�Ʊ�1mol������ת�Ƶĵ�������Ϊ2NA
C.1molNH4NO3��ȫ����ϡ��ˮ�У���Һ�����ԣ���Һ��NH4+����ĿΪNA
D.9.0g�����Ǻ����ǵĻ�����к�̼ԭ�ӵ���ĿΪ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ������Cu��Fe2O3��ɵĻ���ƽ���ֳ����ȷ֣�������һ�ݼ���2mol/L��������Һ150mL��ǡ����ȫ�ܽ⣬������Һ����KSCN��Ѫ��ɫ���֡����ù�����CO�ڸ����»�ԭԭ����������������Ϊ
A.1.6gB.2.4gC.3.2gD.4.8g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڴ�ͳ�ĵ���Ȼ���������������Ļ����ϣ���ѧ���������̼���缫���������һ���µĹ��շ�������Ҫ�����绯ѧ���̺ͻ�ѧ���̣���ͼ��ʾ������˵����ȷ����
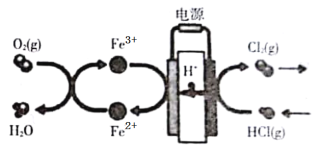
A.�����������ķ�Ӧ��Fe3++e��= Fe2+��4Fe2++O2+4H+=4Fe3++2H2O
B.Fe2+�ڹ��������������
C.�������Ͽ�ѡ��Ag
D.��·��ת��1 mol����ʱ����������5.6L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڰ�����व�ͭ��������л����Գƺϳ�������յ�ЧӦ����ṹ��ʽ��ͼ����ʾ��
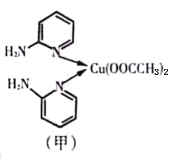
(1)��̬Cuԭ�ӵļ۵����Ų�ʽΪ__________________����Ԫ�����ڱ���ͭλ��_____��(�s������P������d����ds��)
(2)C��N��O��һ�������ɴ�С��˳��Ϊ________________��
(3)�ڰ�����व�ͭ������У�Cu2+����λ����___________��Nԭ�ӵ��ӻ�����Ϊ_____________��
(4)��ͼ����ʾ��Fe3O4�������У�O2-Χ�����������϶(1��3��6��7����Χ��)�����������϶(3��6��7��8��9��12����Χ��)��Fe3O4����һ���Fe3+��������������϶�У�Fe2+����һ��Fe3+��������������϶�У����������������϶�����������϶��֮��Ϊ___________����_______________%�����������϶û����������ӡ�
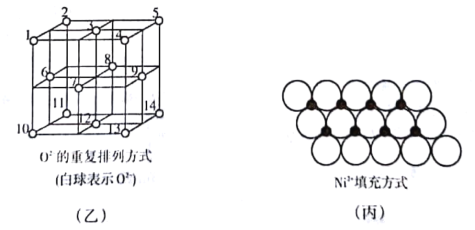
(5)һ���¶��£�NiO��������Է��ط�ɢ���γɡ������Ӳ㡱��������ΪO2-�����õ������У�Ni2+�������(��ͼ��)����֪O2-�İ뾶Ϊa nm��ÿƽ��������Ϸ�ɢ�ĸþ��������Ϊ________g(��a��NA��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ͨ������SiO2 ��̼��Ӧ����ȡ�裬д����Ӧ�Ļ�ѧ����ʽ___________________��
��ҵ�ϻ���������þ��ȡ�裬��ӦΪ2Mg+SiO2 = 2MgO+Si��ͬʱ�ᷢ������Ӧ��2Mg + Si = Mg2Si����ͼ�ǽ���Mg��SiO2��Ӧ��ʵ��װ�ã��Իش��������⣺

��1������O2��H2O��g���Ĵ��ڶԸ�ʵ���нϴ�Ӱ�죬ʵ����Ӧͨ������X��Ϊ���������Թ��еĹ���ҩƷ��ѡ��________(�����)��
a��ʯ��ʯ������b��п��������c������
��2��ʵ�鿪ʼʱ��������ͨһ��ʱ��X���壬�ټ��ȷ�Ӧ��������� ___________________________������Ӧ���������߾ƾ��ƣ���Ӧ�ܼ������У���ԭ����______________________��
��3����Ӧ��������ȴ������ʱ������Ӧ��Ļ�����м���ϡ���ᣬ�ɹ۲쵽�����Ļ��ǣ������������ԭ���Ǹ�����Mg2Si������Ѹ�ٷ�Ӧ����SiH4�����飩���壬Ȼ��SiH4��ȼ���û�ѧ����ʽ��ʾ��������Ӧ��________________________��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��I�ֱ��ʾ��ѧ��ѧ�г�����һ�����ʣ�����֮�����ϵ����ͼ��ʾ(���ַ�Ӧ�������û���г�)����֪HΪ��̬�����F�Ǻ��ɫ������ˮ�ij�������A��B��C��D��E��F���������о���ͬһ��Ԫ�ء�
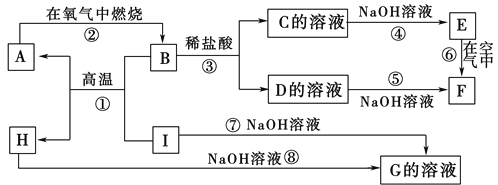
����д���пհף�
(1)A��B��C��D��E��F����������������ͬһ��Ԫ�ص�������________��
(2)��Ӧ�ٵĻ�ѧ����ʽΪ_____________________________________
��Ӧ�۵����ӷ���ʽΪ________________________
��Ӧ��Ļ�ѧ����ʽΪ_____________________________________
��3����Ӧ�����е�������______________________________��
��4��1molI������Ӧ�����ɵ�A��������������ˮ������Ӧ�����ɵ����廻��ɱ�״����ռ______L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ӹ�ҵ���������������ؼ��仯����Ӧ�ù㷺��
��1��һ������������GaN�Ĺ�����ͼ��
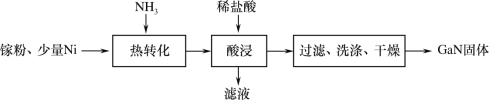
���أ�Ga����ԭ�ӽṹʾ��ͼΪ![]() ����Ԫ�������ڱ��е�λ����___��
����Ԫ�������ڱ��е�λ����___��
������ת����ʱGaת��ΪGaN�Ļ�ѧ����ʽ��___��
�������������Ŀ����___��
��2��ijѧУ��ѧ��ȤС����ʵ����������ͼװ��ģ���Ʊ������أ�
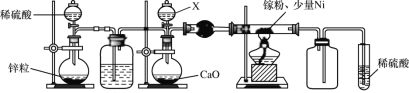
������X�е��Լ���__������ǰ����ͨ��һ��ʱ���H2��ԭ����__��
��ȡijGaN��Ʒm������������NaOH��Һ��������ӦGaN+OH��+H2O![]() GaO2-+NH3������H3BO3��Һ������
GaO2-+NH3������H3BO3��Һ������![]() NH3��ȫ���գ��ζ�����Һʱ����Ũ��Ϊcmol/L������VmL������Ʒ�Ĵ�����___��
NH3��ȫ���գ��ζ�����Һʱ����Ũ��Ϊcmol/L������VmL������Ʒ�Ĵ�����___��
��֪��NH3+H3BO3=NH3H3BO3��NH3H3BO3+HCl=NH4Cl+H3BO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����������������ȷ����( )
A.���³�ѹ�£�1.06g Na2CO3���е�Na+������Ϊ0.01NA
B.��״���£�22.4L�ƾ����еķ�����ΪNA
C.�ڳ��³�ѹ�£�28gN2��CO����������������ķ�����Ŀһ��ΪNA
D.���ʵ���Ũ��Ϊ0.5mol/L��MgCl2��Һ�У�����Cl-����ΪNA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com