
【题目】用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是________;
(2)大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大、偏小、无影响”);盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热____________(填“偏大、偏小、无影响”);在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热会____________(填“偏大”、“偏小”或“不变”)。
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会____________(填“偏大”、“偏小”或“不变”),其原因是_______________________________________________。
(4)该实验小组做了三次实验,每次取溶液各50 mL,并记录下原始数据(见下表)。
实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g·℃),则该反应的中和热为ΔH=_______。根据计算结果,写出该中和反应的热化学方程式______________________。
(5)实验中改用60 mL 1.0 mol·L-1的盐酸跟50 mL 1.1mol·L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热__________ (填“相等”或“不相等”)。
【答案】 环形玻璃搅拌棒 偏小 偏小 偏小 偏小 用醋酸代替盐酸,醋酸电离要吸收能量,造成测得的中和热偏小 -56.0kJ/mol HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) △H=-56.01kJ/mol 不相等 相等
【解析】考查中和热的测定,(1)根据装置图,缺少的玻璃仪器是环境玻璃搅拌棒 ;(2)根据公式为△H=- kJ·mol-1,大烧杯上如果不盖硬纸板,造成热量的损失,即t终偏小,即中和热的数值偏小;造成盐酸挥发,产生的热量偏小,即所测中和热偏小;未洗盐酸,就测氢氧化钠,造成起始温度的平均值偏高,即产生热量偏小;(3)醋酸属于弱酸,醋酸的电离吸热过程,如果用醋酸与NaOH反应,产生热量偏小,所测中和热数值偏小;(4)三次温差的平均值为(6.6+6.7+6.8)/3=6.7,生成H2O的物质的量为50×10-3×1.0mol=0.05mol,代入公式求出△H=-56.0kJ·mol-1,热化学反应方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) △H=-56.01kJ/mol ;(5)两个实验物质的物质的量不同,因此放出热量不相等,中和热的定义是:稀酸与稀碱反应生成1molH2O放出的热量,中和热与物质的物质的量无关,因此两个实验所求的中和热数值相等。
kJ·mol-1,大烧杯上如果不盖硬纸板,造成热量的损失,即t终偏小,即中和热的数值偏小;造成盐酸挥发,产生的热量偏小,即所测中和热偏小;未洗盐酸,就测氢氧化钠,造成起始温度的平均值偏高,即产生热量偏小;(3)醋酸属于弱酸,醋酸的电离吸热过程,如果用醋酸与NaOH反应,产生热量偏小,所测中和热数值偏小;(4)三次温差的平均值为(6.6+6.7+6.8)/3=6.7,生成H2O的物质的量为50×10-3×1.0mol=0.05mol,代入公式求出△H=-56.0kJ·mol-1,热化学反应方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) △H=-56.01kJ/mol ;(5)两个实验物质的物质的量不同,因此放出热量不相等,中和热的定义是:稀酸与稀碱反应生成1molH2O放出的热量,中和热与物质的物质的量无关,因此两个实验所求的中和热数值相等。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是 ( )。
A. 现代药物主要是人工合成的药物
B. 天然药物具有良好的药效,所以不需要进行改造
C. 药物的生物活性跟它的结构中的某些官能团有关
D. 在药物设计领域计算机应用前景广阔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施不符合节能减排的是( )
A. 在屋顶安装太阳能热水器为居民提供生活用热水
B. 大力发展火力发电,解决电力紧张问题
C. 用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D. 用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A分子式为CxHyOz,15g A完全燃烧生成22g CO2和9gH2O。
(1)该有机物的最简式是___________________。
(2)若A是一种无色具存强烈剌激性气味的气体,具有还原性,则其结构简式是_________。
(3)A中只有一种官能团,若A和Na2CO3混合有气体放出,和醇能发生酯化反应,则A的结构简式为___________________。
(4)A中只有一种宫能团,若A是易挥发有水果香味的液体,能发生水解反应,则其结构简式为___________________。
(5)若A其分子结构中含有6个碳原子,具有多元醇和醛的性质,则其结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水银法电解食盐水是氯碱工业发展进程中的重要里程碑,以制得碱液纯度高、质量好而著称,其生产原理示意图如下。下列说法不正确的是

A. 电解器中阳极的电极反应式为2Cl--2e-===Cl2↑
B. 当阳极产生3.36 L(标准状况)气体时,解汞室中生成NaOH的质量为12 g
C. 解汞室中产生氢气的电极为阴极
D. 在直流电作用下,电解器中的Na+变成金属钠,与水银形成钠汞合金,从而与Cl2分开
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用FeS处理含Cu2+和Pb2+废水后的废弃固体(主要成分CuS、FeS、PbS、SiO2)制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:

(1)提高步骤①反应速率的措施,除温度外,还有_____________(写一条);
(2)处理废水时,FeS与Pb2+反应的离子方程式为____________;
(3)固体A的主要成分是_______________(填化学式);
(4)步骤⑤中,所加试剂x为____________(填标号);
a.Cl2 b.H2O2 c.KMnO4 d.HNO3
(5)检验溶液B完全转化为溶液C的试剂是_________________________;
(6)潮湿多雨的夏季,在细菌作用下,废石堆中的硫化铜与硫酸铁转化为含重金属盐的酸性废水(硫元素全部进入溶液中)而污染土壤。该转化反应的离子方程式为____________;
(7)已知,常温下FeS、CuS的Ksp分别为6.5x10-18和1.3x10-36)。现用过量的FeS处理含0.01mol·L-1 Cu2+的废水,处理后废水中c(Cu2+)=______mol·L-1(忽略体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g) === 2HF(g) △H=-270kJ/mol,下列说法正确的是( )
A. 1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
B. 1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C. 在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D. 2mol氟化氢气体分解成1mol的氢气和1mol的氟气放出270kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着社会经济的发展,人们生活水平的提高和对环境要求的加强,来源广泛的高氨氮废水(主要含有NH4+)处理越来越受到重视。对于高氨氮废水的处理有多种方法。
(1)吹脱法:
![]()
使用吹脱法时需要在①中加入碱,写出发生的离子反应方程式______________________。
(2)MAP沉淀法:
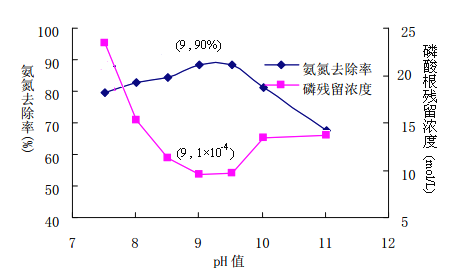
①使用化学沉淀剂处理高氨氮废水时,向高氨氮废水中投入含有Mg2+的物质和H3PO4,调节溶液pH,与NH4+反应生成MgNH4PO4(MAP)沉淀。为有效控制溶液PH,并考虑污水处理效果,则最好选用下列物质中_____。
A MgO B MgSO4 C MgCl2
②控制溶液PH的合理范围为____________________
③从溶解平衡角度解释PH过高或过低不易形成沉淀MAP的原因(已知PO43-在酸性较强条件下以HPO42-形式存在)_______________
(3)生物脱氮传统工艺:
①在有氧气的条件下,借助于好氧微生物(主要是好氧菌)的作用生成NO3-,写出反应的离子方程式_________________________。
②在无氧的酸性条件下,利用厌氧微生物(反硝化菌)的作用使NO3-与甲醇作用生成N2,达到净化水的目的。写出离子方程式____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com