
【题目】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法正确的是( )
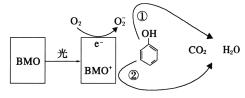
A.该过程的总反应:C6H6O+7O2![]() 6CO2+3H2O
6CO2+3H2O
B.该过程中BMO表现出较强氧化性
C.光催化降解过程中,光能转化为化学能、电能等
D.①和②中被降解的苯酚的物质的量之比为3:1
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】乙醇分子中各种化学键如图所示。下列有关反应断键位置说明错误的是( )
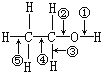
A.乙醇和浓硫酸,共热到170℃时断键②⑤
B.乙醇和浓硫酸,共热到140℃时断键①④
C.乙醇和金属钠的反应断键①
D.乙醇在Cu催化下与O2反应时断键①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.合成氨工业中,每生产![]() ,放出
,放出![]() 热量。
热量。
(1)写出合成氨反应的热化学方程式___________。
(2)已知:

![]() 键断裂吸收的能量等于_______
键断裂吸收的能量等于_______![]() (计算结果取整数)。
(计算结果取整数)。
Ⅱ.人工肾脏可用间接电化学方法除去代谢产物中的尿素[化学式为![]() ],原理如图。
],原理如图。
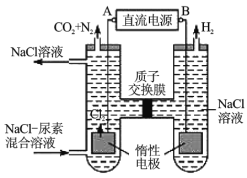
(1)电源的负极为__________(填“A”或“B”)。
(2)阳极室中发生的反应依次为_________,_________。
(3)电解结束后,阴极室溶液的![]() 与电解前相比将__________(填“增大”、“减小”或“不变”)。
与电解前相比将__________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学多米诺实验”即只需控制第一个反应,利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生。如图是一个“化学多米诺实验”,
已知:①Cu2++4NH3H2O=4H2O+[Cu(NH3)4]2+(该反应产物可作为H2O2的催化剂)。
②已知仪器A、C溶液中硫酸浓度相同,实验中所用锌粒完全相同
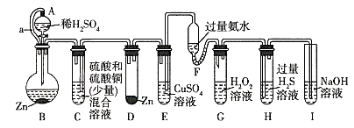
下列有关分析错误的是( )
A.该实验成功的重要条件是整套装置气密性良好
B.B中反应速率大于D中反应速率
C.A和B之间导管a的作用是平衡A和B内气压
D.H中出现浅黄色浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸(反式丁烯二酸)与Fe2+形成的配合物——富马酸亚铁又称富血铁,可用于治疗缺铁性贫血。以下是合成富马酸亚铁的一种工艺路线:

回答下列问题:
(1)A的化学名称为________;由A生成B的反应类型为______。
(2)C的结构简式为______。
(3)富马酸的结构简式为______。
(4)检验富血铁中是否含有Fe3+需要用的试剂是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在煤的化工生产中,我们常常需要研究不同温度下的平衡常数、投料比及产率等问题。已知CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表,
H2(g)+CO2(g)的平衡常数随温度的变化如下表,
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数/K | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)上述反应的正反应是___________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率_________(填“增大”、“减小”或“不变”),容器内混合气体的压强___________(填“增大”、“减小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有_______________(选填字母)。
投料 | A | B | C | D |
n(CO2)/mol | 3 | 1 | 0 | 1 |
n(H2)/mol | 2 | 1 | 0 | 1 |
n(CO)/mol | 1 | 2 | 3 | 0.5 |
n(H2 | 5 | 2 | 3 | 2 |
(4)在830 ℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g),2min达到平衡时,CO的转化率为____________,用CO2表示的平均反应速率V(CO2)为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性联氨燃料电池具有能量密度较高和无污染等特点,其工作原理如下图所示,下列说法不正确的是

A.负极反应:N2H4-4e-=4H++N2↑
B.通入氧气的电极为正极
C.电池工作时OH-向负极移动
D.该电池工作一段时间后,电解质溶液碱性不变(不考虑电解质溶液的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是极具发展潜力的清洁能源,氢气的开发和综合利用是目前全球重要的科研项目之一。回答下列问题:
(1)T℃时,向体积均为1L的甲、乙两个恒容容器中分别加入足量碳和0.1molH2O(g),发生反应:H2O(g)+C(s)CO(g)+H2(g) △H>0。甲容器控制绝热条件,乙容器控制恒温条件,两容器中压强随时间的变化如图所示。
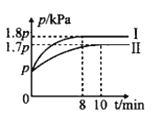
①图中代表甲容器的曲线为__(填“Ⅰ”或“Ⅱ”)。
②下列关于甲容器反应体系的说法错误的是__。
A.当水蒸气的体积分数不再发生变化,反应达到平衡状态
B.从密闭容器中分离出部分固体碳,H2的体积分数减小
C.缩小容器体积,平衡逆向移动,平衡常数减小
D.向平衡体系中充入少量水蒸气,再次平衡后,容器中c(CO)增大
③乙容器中,从反应开始到达平衡,v(H2O)=__molL-lmin-l;T℃下,该反应的平衡常数Kp=___(用含p的代数式表示)。
(2)对于反应aA(g)+bB(g)cC(g)+dD(g),速率方程v═kcm(A)cn(B),k为速率常数(只受温度影响),m+n为反应级数。已知H2(g)+CO2(g)CO(g)+H2O(g),CO的瞬时生成速率=kcm(H2)c(CO2)2。一定温度下,控制CO2起始浓度为0.25molL-1,改变H2起始浓度,进行以上反应的实验,得到CO的起始生成速率和H2起始浓度呈如图所示的直线关系。
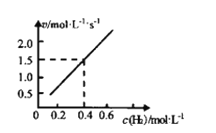
①该反应的反应级数为__。
②速率常数k=__。
③当H2的起始浓度为0.2molL-1,反应进行到某一时刻时,测得CO2的浓度为0.2molL-1,此时CO的生成瞬时速率v=__molL-ls-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com