
| 10.8g |
| 18g/mol |
| ||
| 3.2g |
| 16g/mol |


科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 预期现象和结论 |
| 步骤1:用量筒取样品溶液2mL于试管中,再滴加足量的2mol/L盐酸,充分振荡,观察 | 若 溶液由无色变黄色 溶液由无色变黄色 ,则假设1可能成立;若溶液无明显变化 溶液无明显变化 ,则假设2可能成立 假设2可能成立 . |
| 步骤2:往步骤1 的试管中加入 1mL苯 1mL苯 ,充分振荡,观察 |
若溶液分层,上层有机层出现橙色或橙红色,则假设2成立; 若溶液只分层,无颜色变化,则假设1成立 若溶液分层,上层有机层出现橙色或橙红色,则假设2成立; 若溶液只分层,无颜色变化,则假设1成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
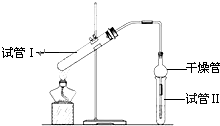 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用图的装置制备乙酸乙酯.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用图的装置制备乙酸乙酯.| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中 试剂 |
有机层的 厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol?L-1 浓硫酸 |
饱和Na2CO3 溶液 |
3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol?L-1H2SO4 |
0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省八县市一中高一下学期期末联考化学试卷(带解析) 题型:实验题
(8分)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用右图的装置制备乙酸乙酯。
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是: 。
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中 试剂 | 有机层的 厚度/cm |
| A | 2 mL乙醇、1 mL乙酸、 1mL18mol·L-1浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
| B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
| C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 | 0.6 | |
| D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
查看答案和解析>>
科目:高中化学 来源:2014届福建省八县市高一下学期期末联考化学试卷(解析版) 题型:实验题
(8分)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用右图的装置制备乙酸乙酯。

(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是: 。
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
|
实验编号 |
试管Ⅰ中试剂 |
试管Ⅱ中 试剂 |
有机层的 厚度/cm |
|
A |
2 mL乙醇、1 mL乙酸、 1mL18mol·L-1 浓硫酸 |
饱和Na2CO3 溶液 |
3.0 |
|
B |
2 mL乙醇、1 mL乙酸 |
0.1 |
|
|
C |
2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 |
0.6 |
|
|
D |
2 mL乙醇、1 mL乙酸、盐酸 |
0.6 |
① 实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是______mL和_____mol·L-1 。
② 分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(3)若现有乙酸90g,乙醇138g发生酯化反应得到80g乙酸乙酯,试计算该反应的产率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用右图的装置制备乙酸乙酯。
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是: 。

(2)为了证明浓硫酸在该反应
中起到了催化剂和吸水剂
的作用,某同学利用上图
所示装置进行了以下4个
实验。实验开始先用酒精灯
微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中 试剂 | 有机层的 厚度/cm |
| A | 2 mL乙醇、1 mL乙酸、 1mL18mol·L-1 浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
| B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
| C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 | 0.6 | |
| D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
① 实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是______mL和_____mol·L-1 。
② 分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(3)若现有乙酸90g,乙醇138g发生酯化反应得到80g乙酸乙酯,试计算该反应的产率为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com