
(1)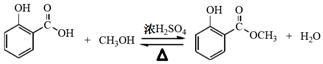 (2分);
(2分);
(2)水浴加热(1分) 反应产生的水从反应体系中分离开来,使得平衡向右移动,同时可以减少甲醇的用量,从而提高反应的产率 (2分)
(3)蒸馏(1分)
(4)水杨酸(1分) 不可以(1分) 在氢氧化钠溶液中水杨酸甲酯发生水解(1分)
(5)取少量晶体于试管中,加蒸馏水溶解,滴加NaHCO3溶液,若出现无色气泡则含水杨酸(答案合理即可)(2分) 55%(2分)
解析试题分析:(1)制备冬青油的化学方程式为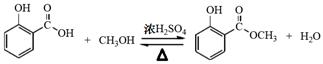 (2分)
(2分)
(2)制备冬青油时,85—95℃最合适的加热方法是水浴加热;实验中加入甲苯作带水剂的目的是反应产生的水从反应体系中分离开来,使得平衡向右移动,同时可以减少甲醇的用量,从而提高反应的产率;
(3)因为甲醇的沸点低,分离甲醇的操作是蒸馏;
(4)用碳酸氢钠溶液洗涤主要除去的杂质是酸性物质水杨酸;NaOH不可以做洗涤剂,因为在氢氧化钠溶液中水杨酸甲酯发生水解;
(5)检验产品中是否含有水杨酸的化学方法是取少量晶体于试管中,加蒸馏水溶解,滴加NaHCO3溶液,若出现无色气泡则含水杨酸(答案不唯一);6.9 g (0.05 mol)水杨酸应得到0.05mol水杨酸甲酯,即7.6g,产品的质量为4.2 g,故所得水杨酸甲酯的产率为55%。
考点:化学实验设计与评价。


科目:高中化学 来源: 题型:单选题
如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是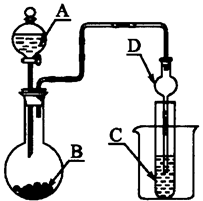
| A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液不褪色 |
| B.若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 |
| C.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色 |
| D.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
三氯化铁熔点282 ℃、沸点315 ℃,能吸收空气里的水分而潮解。它可广泛用于污水处理、电子工业、印染业、建筑业,某化学实验小组的同学欲用下列仪器制备FeCl3固体。
(1)写出制备氯气时的离子方程式_______________________
(2)所选用的仪器连接顺序(填写接口字母)为___________n→d__________
(3)实验过程中,给A、B仪器加热的顺序为_____________________,这样操作的目的是_______________,可作为点燃B处酒精灯的实验标志是_________________;若C可以用D代替,则使用C的目的是______________________。若缺少此类装置,此B中可能发生的另一个反应的方程式为________________________。
(4)有同学认为,若不使用E装置,则B中会有FeCl2生成,请设计一个实验确定此观点是否正确________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以白云石(化学式表示为MgCO3·CaCO3)为原料制备Mg(OH)2的工艺流程如下图所示。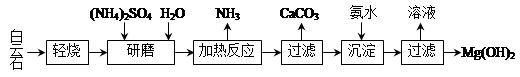
(1)研磨的作用是 。
(2)该工艺中可循环使用的物质是 、 (写化学式)。
(3)白云石轻烧的主要产物是MgO·CaCO3,而传统工艺是将白云石加热分解为MgO和CaO后提取,白云石轻烧的优点是 。
(4)加热反应的离子方程式为 。
(5)①加热反应时,在323k和353k溶液中c(NH4+)与反应时间的关系如下图所示,请在下图画出373k的曲线。
②由图可知,随着温度升高: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
今有下列气体:H2、Cl2、HCl、NH3、NO、H2S、SO2,用如图所示的装置进行实验,填空下列空白:
(1)烧瓶干燥时,从A口进气可收集的气体是________,从B口进气可收集的气体是______________。
(2)烧瓶中充满水时,可用来测量___________等气体的体积。
(3)当烧瓶中装入洗液,用于洗气时,气体应从________口进入烧瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。下图是以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料生产钛白粉并获得副产品FeSO4·7H2O的工艺流程图。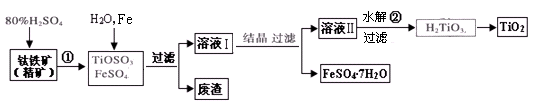
(1)钛铁矿与硫酸发生反应①的化学方程式为 ;在TiOSO4和FeSO4溶液中加入Fe的目的是 。
(2)溶液Ⅱ中TiOSO4在加热条件下发生水解反应②的离子方程式为 ;可回收利用的物质是 。
(3)为测定溶液Ⅱ中TiOSO4的含量,首先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用 (填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,当溶液出现红色达到滴定终点,用去了30.00mL FeC13溶液。待测钛液中TiOSO4的物质的量浓度是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)某化学兴趣小组用如下图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。

图1 图2
(1)写出该实验中生成乙烯的化学方程式 。
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是 。
a.乙烯与溴水易发生取代反应
b.使溴水褪色的反应,未必是加成反应
c.使溴水褪色的物质,未必是乙烯
(3)乙同学经过细致观察后试管中另一现象后并借用pH试纸测定,证明反应中有乙烯生成,请简述
。
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加上图2装置以除去乙醇蒸气和SO2,则A中的试剂是 ,B中的试剂为 。
(5)处理上述实验后烧瓶中废液的正确方法是 。
a.冷却后倒入下水道中 b.冷却后倒入空废液缸中 c.冷却后加水稀释,倒入废液缸中,加废碱中和
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)草酸是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸。某学习小组的同学拟以甘蔗渣为原料用水解—氧化—水解循环进行制取草酸。
|
 请跟据以上信息回答下列问题:
请跟据以上信息回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的
实验装置。
(1)实验室用装置A制备SO2某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未
流下,你认为原因可能是:
(2)实验室用装置E制备Cl2其反应的化学化学方程式为:MnO2+4HCl(浓)=C12↑+MnCl2+2H2O
浓盐酸的作用为:
(3)反应开始一段时间后,观察到 B、D两个试管中的品红溶液出现的现象是:
B: D 。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B: D 。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性.二者混合后的漂白性肯定会更强。他们将制得的SO2和CI2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示): 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com